วัคซีนเป็นผลิตภัณฑ์ชีวภาพ เมื่อให้เข้าสู่ร่างกายจะกระตุ้นให้ร่างกายสร้างภูมิคุ้มกันเพื่อป้องกันโรค เช่นเดียวกับวัคซีนโควิด-19 ที่ให้เพื่อป้องกัน “โควิด-19 (COVID-19)” ซึ่งเป็นโรคติดเชื้อที่ทางเดินหายใจ เกิดจากโคโรนาไวรัสสายพันธุ์ใหม่ คือ “2019-nCoV (2019 novel coronavirus)” หรือ “severe acute respiratory syndrome coronavirus 2 (SARS-CoV-2)” เริ่มเกิดการระบาดที่เมืองอู่ฮั่นในประเทศจีน (Wuhan, China) เมื่อเดือนธันวาคมปี พ.ศ. 2562 (ค.ศ. 2019) และการระบาดดำเนินมาจนถึงทุกวันนี้ ขณะนี้มีวัคซีนโควิด-19 ชนิดต่าง ๆ ซึ่งมีกรรมวิธีในการผลิตแตกต่างกันออกใช้แล้วมากมาย ในขณะเดียวกันไวรัสก่อโรคมีการกลายพันธุ์อย่างต่อเนื่องจนทำให้ประสิทธิผลของวัคซีนโควิด-19 ในการป้องกันโรคไม่เป็นไปตามเป้าหมาย ขณะนี้ยังคงมีผู้เสียชีวิตด้วยโควิด-19 เป็นจำนวนมากซึ่งส่วนหนึ่งเป็นผู้ที่ได้รับวัคซีนมาแล้ว จึงเป็นที่กังวลถึงประสิทธิภาพของวัคซีนที่ใช้อยู่ อีกทั้งยังไม่อาจคาดหวังว่าจะต้องได้รับวัคซีนเพิ่มเติมอีกเท่าใดจึงจะป้องกันโควิด-19 ได้ ในบทความนี้ให้ข้อมูลเกี่ยวกับวัคซีนและประสิทธิผลของวัคซีนโควิด-19 ในด้านเหล่านี้ ได้แก่ วัคซีนกับการป้องกันโรค, สิ่งที่ใช้ประเมินประสิทธิผลของวัคซีน, ประสิทธิผลของวัคซีนลดลงในช่วงที่ผ่านมา, ภูมิคุ้มกันระยะยาวของวัคซีน, ภูมิคุ้มกันลูกผสมหรือภูมิคุ้มกันไฮบริด, การให้วัคซีนเข็มกระตุ้นเพิ่มเติม และปัจจัยที่ส่งผลต่อประสิทธิผลของวัคซีน
วัคซีนกับการป้องกันโรค
วัคซีนเป็นผลิตภัณฑ์ชีวภาพที่มีส่วนประกอบของสารก่อภูมิต้านทานหรือแอนติเจน (antigen) หรือมีส่วนประกอบของสิ่งที่ไปทำให้ร่างกายสร้างแอนติเจน เมื่อให้วัคซีนเข้าสู่ร่างกายจะกระตุ้นให้ร่างกายสร้างภูมิคุ้มกันโรคคล้ายกับการกระตุ้นเมื่อเกิดการติดเชื้อ ในกรณีของวัคซีนโควิด-19 แอนติเจนเป็นสไปก์โปรตีนหรือโปรตีนเอส (spike protein หรือ protein S) ซึ่งเป็นโปรตีนบนผิวไวรัสโควิด-19 ทำหน้าที่กระตุ้นร่างกายให้สร้างภูมิคุ้มกันแบบจำเพาะ (acquired immunity หรือ adaptive immunity) มีทั้งภูมิคุ้มกันชนิดสารน้ำหรือแอนติบอดี (humoral immunity หรือ antibody-mediated immunity) ซึ่งอาศัยการทำงานของเซลล์เม็ดเลือดขาวชนิดบี-ลิมโฟไซต์ (B lymphocyte หรือ B cell) และภูมิคุ้มกันชนิดพึ่งเซลล์ (cellular immunity หรือ cell-mediated immunity) ซึ่งอาศัยการทำงานของเซลล์เม็ดเลือดขาวชนิดที-ลิมโฟไซต์ (T lymphocyte หรือ T cell) ในกระบวนการสร้างภูมิคุ้มกันนี้บี-ลิมโฟไซต์ที่ถูกปลุกฤทธิ์จะเปลี่ยนเป็นพลาสมาเซลล์ (plasma cell) และสร้างแอนติบอดีที่จำเพาะต่อแอนติเจนนั้นอย่างรวดเร็วภายใน 2-3 วันเพื่อใช้กำจัดแอนติเจน ส่วนการตอบสนองทางภูมิคุ้มกันชนิดพึ่งเซลล์โดยที-ลิมโฟไซต์ต้องอาศัยเซลล์แสดงแอนติเจน (antigen presenting cell หรือ APC เช่น dendritic cell, macrophage, B lymphocyte ซึ่งทำหน้าที่เป็น APC ได้ด้วย) ที่รับเอาแอนติเจนไว้เพื่อให้เกิดกระบวนการกระตุ้นทำงานของที-ลิมโฟไซต์และการปลุกฤทธิ์ที-ลิมโฟไซต์ชนิดที่ทำหน้าที่ฆ่าเซลล์ที่ติดไวรัสได้ (ที-ลิมโฟไซต์ที่ทำหน้าฆ่าเซลล์ได้ มีชื่อเรียกหลายอย่าง เช่น cytotoxic T lymphocyte, killer T cell) เป็นการหยุดยั้งการเพิ่มจำนวนของไวรัส (เนื่องจากไวรัสจะเพิ่มจำนวนได้ต้องอยู่ภายในเซลล์) และหยุดการแพร่กระจายของไวรัสไปสู่เซลล์อื่น ด้วยเหตุนี้วัคซีนจึงช่วยป้องไม่ให้เกิดโรค
ประสิทธิผลของวัคซีนโควิด-19 ประเมินจากอะไร?
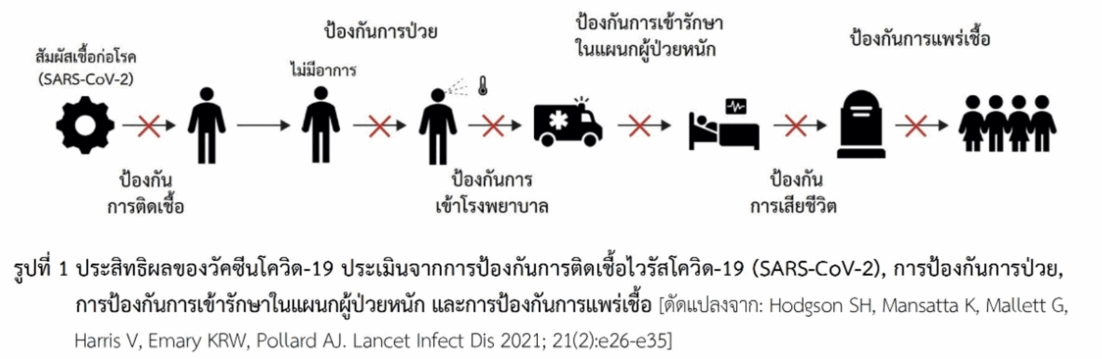
ประสิทธิผลของวัคซีน (vaccine effectiveness) ในการป้องกันโรคเมื่อให้กับประชาชนกลุ่มเสี่ยง สามารถประเมินผลจากการป้องกันสิ่งเหล่านี้ ได้แก่ การป้องกันการติดเชื้อ (SARS-CoV-2), การป้องกันการป่วย, การป้องกันการป่วยรุนแรงที่ต้องเข้ารักษาในแผนกผู้ป่วยหนักหรือแผนกผู้ป่วยวิกฤติ (intensive care unit หรือ ICU) และการป้องกันการแพร่เชื้อ (รูปที่ 1) ซึ่งการประเมินในด้านการป้องกันการแพร่เชื้อทำได้ค่อนข้างยากเนื่องจากมีปัจจัยที่เกี่ยวข้องหลายอย่าง ในการศึกษาโดยทั่วไปจึงไม่ได้กล่าวถึง
 “วัคซีนให้ประสิทธิผล 95%” หมายความว่าอย่างไร?
“วัคซีนให้ประสิทธิผล 95%” หมายความว่าอย่างไร?
ประสิทธิผลของวัคซีนโควิด-19 ที่พบในการศึกษาต่าง ๆ เป็นการบอกถึงการลดความเสี่ยงต่อการเกิดโรคที่ช่วงเวลาหนึ่งหลังจากได้รับวัคซีน อาจเป็นการลดความเสี่ยงด้านการติดเชื้อ การป่วย หรือการป่วยรุนแรง (แล้วแต่กรณี) ในกลุ่มประชากรที่ได้รับวัคซีนเทียบกับกลุ่มที่ไม่ได้รับวัคซีน (เป็น relative risk reduction) โดยคิดเป็นค่าร้อยละ ซึ่งตัวเลขที่ระบุสามารถคำนวณจาก 100 คูณด้วยอัตราส่วนระหว่างร้อยละของความเสี่ยงที่ลดลงในกลุ่มที่ได้รับวัคซีนกับร้อยละของความเสี่ยงในกลุ่มที่ไม่ได้รับวัคซีน เช่น วัคซีนโควิด-19 ยี่ห้อหนึ่งหลังจากฉีดครบแล้วนาน 1 เดือน ในกลุ่มที่ได้รับวัคซีน 100,000 คน มีผู้ป่วย 100 คน (0.1%) ในขณะที่กลุ่มที่ไม่ได้รับวัคซีน 100,000 คน มีผู้ป่วย 2,000 คน (2%) ดังนั้นอัตราส่วนระหว่างร้อยละของความเสี่ยงที่ลดลงในกลุ่มที่ได้รับวัคซีนกับร้อยละของความเสี่ยงในกลุ่มที่ไม่ได้รับวัคซีนเท่ากับ (2–0.1)/2=0.95 เมื่อคูณด้วย 100 จึงเท่ากับ 95% ดังนั้นวัคซีนโควิด-19 ยี่ห้อนั้นให้ประสิทธิผลในการป้องกันการป่วยได้ 95% หลังจากฉีดครบแล้วนาน 1 เดือน จะเห็นได้ว่า “ประสิทธิผลในการป้องกันการป่วย 95%” ไม่ได้หมายความว่าในผู้ที่ฉีดวัคซีนครบแล้ว 100 คน วัคซีนจะช่วยไม่ให้ป่วยได้ 95 คน และไม่ได้หมายความว่าวัคซีนทำงานได้เพียง 95%
ประสิทธิผลของวัคซีนโควิด-19 ลดลงในช่วงที่ผ่านมา
มีการศึกษามากมายถึงประสิทธิผลของวัคซีนโควิด-19 ในการป้องกันโรคที่ช่วงเวลาต่าง ๆ หลังจากได้รับการฉีดวัคซีนครบแล้ว วิธีการศึกษามีหลากหลาย (randomised controlled trial, retrospective cohort, prospective cohort, test negative case-control study เป็นต้น) ซึ่งคุณภาพของการศึกษาต่างกันได้ตามข้อจำกัดในวิธีการศึกษาเหล่านั้น ประกอบกับมีปัจจัยอื่นอีกหลายอย่างที่ส่งผลต่อประสิทธิผลของวัคซีน (มีกล่าวต่อไป) อย่างไรก็ตามจากรายงานที่เผยแพร่ตั้งแต่ช่วงครึ่งหลังของปี พ.ศ. 2564 ถึงไตรมาสแรกของปี พ.ศ. 2565 พบว่าประสิทธิผลของวัคซีนโควิด-19 ลดลง ไม่ว่าจะเป็นวัคซีนที่มีแพลตฟอร์ม (platform ซึ่งในที่นี้หมายถึงโครงสร้างพื้นฐานของวัคซีนที่เกิดจากกรรมวิธีหรือเทคโนโลยีที่ใช้ผลิตวัคซีน) ชนิดเอ็มอาร์เอ (messenger ribonucleic acid หรือ mRNA) เช่น วัคซีนไฟเซอร์ (Pfizer COVID-19 vaccine ที่มีชื่อการค้า Comirnaty), วัคซีนโมเดอร์นา (Moderna COVID-19 vaccine หรือ mRNA-1273) หรือแพลตฟอร์มชนิดที่มีอะดีโนไวรัสเป็นพาหะ (adenovirus vector) เช่น วัคซีนแอสทราเซเนกา (AstraZeneca COVID-19 vaccine ที่มีชื่อการค้า Vaxzevria) ล้วนให้ประสิทธิผลลดลงหลังจากได้รับวัคซีนครบแล้วราว 4-6 เดือน ไม่ว่าจะประเมินในด้านป้องกันการติดเชื้อไวรัสโควิด-19 ไม่ว่าสายพันธุ์ใด (ในช่วงที่ทำการศึกษาส่วนใหญ่พบสายพันธุ์เดลตา), ป้องกันการป่วย และป้องกันการป่วยรุนแรง ทั้งในกลุ่มเด็ก (ตั้งแต่ 12 ปีขึ้นไป), ผู้ใหญ่ (ตั้งแต่ 18 ปีขึ้นไป) และผู้สูงอายุ (ตั้งแต่ 65 ปีขึ้นไป) โดยภาพรวมแล้วหลังจากได้รับวัคซีนครบจะให้ประสิทธิผลโดยประมาณดังนี้ ด้านป้องกันการติดเชื้อไวรัสโควิด-19 ไม่ว่าสายพันธุ์ใดในเดือนแรกค่าอยู่ที่มากกว่า 80% และหากเกิน 5 เดือนเหลือค่ามากกว่า 50%, ด้านป้องกันการป่วยในเดือนแรกค่าอยู่ที่มากกว่า 90% และหากเกิน 5 เดือนเหลือค่ามากกว่า 60% และด้านป้องกันการป่วยรุนแรงในเดือนแรกค่าอยู่ที่มากกว่า 90% และหากเกิน 5 เดือนเหลือค่ามากกว่า 70% หากเปรียบเทียบประสิทธิผลระหว่างวัคซีนทั้งสองแพลตฟอร์มพบว่าวัคซีนชนิดเอ็มอาร์เอให้ประสิทธิผลในด้านต่าง ๆ ที่กล่าวมาสูงกว่าวัคซีนชนิดที่มีอะดีโนไวรัสเป็นพาหะ จากข้อมูลข้างต้นจะเห็นได้ว่าแม้ประสิทธิผลของวัคซีนในการป้องกันการติดเชื้อไวรัสโควิด-19 จะลดลงมาก แต่ยังคงให้ประสิทธิผลสูงในด้านป้องกันการป่วยรุนแรงแม้ได้รับวัคซีนเกิน 5 เดือนแล้ว
ไวรัสกลายพันธุ์ทำให้ประสิทธิผลของวัคซีนโควิด-19 ลดลง
ไวรัสเปลี่ยนแปลงพันธุกรรมและกลายพันธุ์ได้ทุกขณะเมื่อมีการเพิ่มจำนวน โดยอาร์เอ็นเอไวรัส (RNA virus ซึ่งหมายถึงไวรัสที่มีสารพันธุกรรมเป็น ribonucleic acid หรือ RNA) จะกลายพันธุ์ได้เร็วกว่าดีเอ็นเอไวรัส (DNA virus ซึ่งหมายถึงไวรัสที่มีสารพันธุกรรมเป็น deoxyribonucleic acid หรือ DNA) และไวรัสชนิดพันธุกรรมสายเดี่ยว (single-stranded virus) ซึ่งพบเป็นส่วนใหญ่จะกลายพันธุ์ได้เร็วกว่าไวรัสชนิดพันธุกรรมสายคู่ (double-strand virus) สำหรับไวรัสโควิด-19 เป็นอาร์เอ็นเอไวรัสชนิดพันธุกรรมสายเดี่ยวจึงพบการกลายพันธุ์ได้เร็ว มีสายพันธุ์ใหม่เกิดขึ้นมากมาย การกลายพันธุ์อาจเพิ่มหรือลดความรุนแรงในการก่อโรคซึ่งไม่อาจพยากรณ์ได้ สายพันธุ์ที่มีการระบาดและทำให้มีผู้เสียชีวิตเป็นจำนวนมากนับตั้งแต่เริ่มต้นมาจนถึงขณะนี้ ได้แก่ สายพันธุ์แอลฟา (Alpha: B.1.1.7), สายพันธุ์เบตา (Beta: B.1.351), สายพันธุ์แกมมา (Gamma: P.1), สายพันธุ์เดลตา (Delta: B.1.617.2) และสายพันธุ์โอมิครอน (Omicron: B.1.1.529) ซึ่งบางสายพันธุ์ยังแบ่งเป็นสายพันธุ์ย่อย เช่น โอมิครอนสายพันธุ์ย่อย BA.1, BA.1.1, BA.2 และ BA.3 ในการกลายพันธุ์นั้นหากเกิดที่สไปก์โปรตีนและมีการกลายพันธุ์หลายตำแหน่ง ไวรัสจะสามารถหลบหนีแอนติบอดีและเข้าจับกับตัวรับที่ทางเดินหายใจได้ดีขึ้น เพิ่มการเข้าสู่ภายในเซลล์ทางเดินหายใจ ทำให้ไวรัสเจริญและเพิ่มจำนวน ตลอดจนแพร่กระจายไปยังเซลล์อื่น มีรายงานถึงประสิทธิผลของวัคซีนโควิด-19 ชนิดเอ็มอาร์เอนเอซึ่งป้องกันไวรัสสายพันธุ์ดั้งเดิมได้ 94-95%, ป้องกันสายพันธุ์เดลตาได้ 63-88% และป้องกันสายพันธุ์โอมิครอนได้ 23-37% ส่วนวัคชีนชนิดที่มีอะดีโนไวรัสเป็นพาหะป้องกันไวรัสสายพันธุ์ดั้งเดิมได้ 70%, ป้องกันสายพันธุ์เดลตาได้ 42-60% และป้องกันสายพันธุ์โอมิครอนแทบไม่ได้เลย ด้วยเหตุนี้หากผลิตวัคซีนที่มีความจำเพาะต่อสายพันธุ์ที่ระบาดจะให้ประสิทธิผลในการป้องกันโรคได้สูง อย่างไรก็ตามอาจประสบปัญหาเช่นเดิมเนื่องจากการกลายพันธุ์ของไวรัสโควิด-19 เกิดได้เร็ว
ภูมิคุ้มกันที่เกิดจากวัคซีนโควิด-19 ค่อย ๆ ลดลง
เมื่อเกิดการติดเชื้อไวรัสโควิด-19 หรือได้รับการกระตุ้นด้วยแอนติเจนจากวัคซีนจะมีสารภูมิต้านทานชนิดที่เป็นแอนติบอดีต่อสไปก์โปรตีนออกมาภายใน 2-3 วันเพื่อต่อสู้กับเชื้อโรคหรือแอนติเจน แอนติบอดีจะเพิ่มขึ้นและอยู่ในระดับสูงนานเป็นสัปดาห์หรือเป็นเดือนก่อนที่จะค่อย ๆ ลดลง การฉีดวัคซีนโควิด-19 เข้ากล้ามเนื้อแอนติบอดีที่ร่างกายสร้างเป็นชนิดอิมมูโนโกลบูลินจีหรือไอจีจี (immunoglobulin G หรือ IgG) มีประสิทธิภาพไม่เท่าแอนติบอดีชนิดอิมมูโนโกลบูลินเอหรือไอจีเอ (immunoglobulin A หรือ IgA) ซึ่งพบที่ชั้นเมือก เช่น ในจมูก ปาก ทางเดินหายใจ แต่ไอจีจีอยู่ในกระแสเลือดจึงสามารถเดินทางไปทำหน้าที่ต่อสู้กับเชื้อโรคในเนื้อเยื่อต่าง ๆ ได้แม้ว่าจะต้องใช้เวลาและต้องการปริมาณแอนติบอดีที่มากพอ เมื่อได้จัดการกับเชื้อโรคหรือแอนติเจนแล้วแอนติบอดีจะลดลงจนตรวจไม่พบ เช่นเดียวกันที-ลิมโฟไซต์ชนิดฆ่าเซลล์จะลดลงมากด้วย การวัดที-ลิมโฟไซต์ชนิดนี้ทำได้ยุ่งยากส่วนใหญ่จึงวัดเฉพาะแอนติบอดี จากข้อมูลที่ผ่านมาแอนติบอดีต่อให้สไปก์โปรตีนลดลงมากภายหลังได้รับวัคซีนแล้วราว 4-6 เดือนไม่ว่าจะเป็นวัคซีนแพลตฟอร์มใด แต่ในผู้ที่ติดเชื้อไวรัสโควิด-19 แอนติบอดีจะอยู่ได้นานไม่น้อยกว่า 11 เดือนหลังการติดเชื้อ อย่างไรก็ตามแม้ว่าแอนติบอดีและที-ลิมโฟไซต์ชนิดฆ่าเซลล์จะลดลงจนตรวจไม่พบแต่ภูมิคุ้มกันยังไม่หมดไป ยังคงมีภูมิคุ้มกันระยะยาวดังที่จะกล่าวต่อไป
ภูมิคุ้มกันระยะยาวภายหลังได้รับวัคซีนโควิด-19
ระบบภูมิคุ้มกันมีความซับซ้อนมาก แม้ว่าแอนติบอดีและที-ลิมโฟไซต์ชนิดฆ่าเซลล์จะลดลงจนตรวจไม่พบภายหลังจากจัดการกับเชื้อโรคหรือแอนติเจนแล้ว แต่ภูมิคุ้มกันยังไม่หมดไป ยังมีภูมิคุ้มกันระยะยาวโดยบี-ลิมโฟไซต์และที-ลิมโฟไซต์ กรณีของบี-ลิมโฟไซต์เซล์ที่ทำหน้าที่มีทั้งพลาสมาเซลล์ชนิดอายุยืน (long-lived plasma cell หรือ long-lived B cell) ที่หลบซ่อนในไขกระดูกซึ่งพร้อมที่จะสร้างแอนติบอดีได้อีกนานอาจหลายเดือนหรือหลายสิบปี มีรายงานว่าพบพลาสมาเซลล์ชนิดอายุยืนในผู้ที่เคยติดเชื้อไวรัสโควิด-19 แต่ไม่พบเซลล์ชนิดนี้ในผู้ได้รับวัคซีนโควิด-19 ชนิดเอ็มอาร์เอ็นเอ (ที่ไม่เคยติดเชื้อมาก่อน) และบี-ลิมโฟไซต์อีกชนิดหนึ่งที่มีบทบาทในการสร้างภูมิคุ้มกันระยะยาวคือบี-ลิมโฟไซต์ชนิดเมมโมรีเซลล์หรือเซลล์ความจำ (memory B cell) จะทำหน้าที่สร้างแอนติบอดีมากมายทันทีหากได้รับเชื้อก่อโรคชนิดเดิม อีกทั้งมีบี-ลิมโฟไซต์ชนิดเมมโมรีเซลล์บางส่วนแต่จำนวนเล็กน้อยที่พร้อมต่อสู้กับพวกเชื้อกลายพันธุ์ ด้วยเหตุนี้จึงเป็นความหวังว่าวัคซีนโควิด-19 แม้ผลิตบนพื้นฐานเพื่อป้องไวรัสโควิด-19 สายพันธุ์แรกเริ่มก็อาจให้ผลในการป้องกันเชื้อกลายพันธุ์ได้บ้าง ส่วนที-ลิมโฟไซต์ชนิดเมมโมรีเซลล์ (memory T cell) ที่หลงเหลือและหลบซ่อนอยู่ในเนื้อเยื่อบางแห่งก็เช่นเดียวกัน พร้อมที่จะเปลี่ยนแปลงตัวเองใหม่กลายเป็นที-ลิมโฟไซต์ชนิดฆ่าเซลล์เพื่อการทำหน้าที่ต่อสู้กับเชื้อก่อโรคชนิดเดิม เมมโมรีเซลล์ที่เกิดหลังการติดเชื้อไวรัสบางชนิดหรือหลังจากได้รับวัคซีนบางชนิดอาจมีอายุนานหลายสิบปีหรือนานตลอดชีวิต เช่น วัคซีนหัด หรือการติดเชื้อไข้ทรพิษในอดีต อย่างไรก็ตามพวกเมมโมรีเซลล์เหล่านี้มีความจำเพาะสูงต่อแอนติเจน ด้วยเหตุนี้หากเชื้อก่อโรคมีการกลายพันธุ์สูงจะทำให้ระบบภูมิคุ้มกันทำงานได้ไม่ดี ขณะนี้ยังไม่อาจคาดการณ์ได้ว่าภูมิคุ้มกันระยะยาวที่เกิดจากวัคซีนโควิด-19 มีมากหรือน้อยและอยู่ได้นานเพียงใด แต่คาดว่าเมมโมรีเซลล์ชนิดที-ลิมโฟไซต์จะยังคงทำหน้าที่ได้ดีภายหลังฉีดวัคซีนเกิน 6 เดือน ตามผลการศึกษาที่พบว่าวัคซีนโควิด-19 ยังให้ประสิทธิผลในการลดอาการป่วยรุนแรงและการเสียชีวิตได้
การให้วัคซีนโควิด-19 เข็มกระตุ้นเพิ่มเติมช่วยเพิ่มการป้องกันโรค
ภูมิต้านทานที่เกิดจากวัคซีนโควิด-19 ไม่ได้อยู่ถาวร แอนติบอดีต่อให้สไปก์โปรตีนของไวรัสโควิด-19 ลดลงมากราว 4-6 เดือนภายหลังได้รับวัคซีนไม่ว่าแพลตฟอร์มใด ดังได้กล่าวแล้วข้างต้น ประกอบกับการกลายพันธุ์ของไวรัสทำให้ประสิทธิผลของวัคซีนโควิด-19 ลดลงมาก การให้วัคซีนเข็มกระตุ้นเพิ่มเติมในเวลาที่เหมาะสมเมื่อภูมิต้านทานลดลงแล้วจะช่วยเพิ่มการป้องกันโรค อีกทั้งคาดหวังว่าจะช่วยเพิ่มจำนวนบี-ลิมโฟไซต์ชนิดเมมโมรีเซลล์และเพิ่มความหลากหลายในการสร้างแอนติบอดีเพื่อต่อสู้กับพวกเชื้อกลายพันธุ์ ตลอดจนเพิ่มจำนวนที-ลิมโฟไซต์ชนิดเมมโมรีเซลล์เพื่อช่วยป้องกันความรุนแรงของโรค มีการศึกษาในช่วงที่ผ่านมาพบว่าการฉีดวัคซีนโควิด-19 เข็มที่ 3 ช่วยเพิ่มประสิทธิผลในการป้องกันความเจ็บป่วย (ลดการติดเชื้อและลดความรุนแรงของโรค) ที่เกิดจากไวรัสสายพันธุ์เดลตาและสายพันธุ์โอมิครอนได้เพิ่มขึ้น
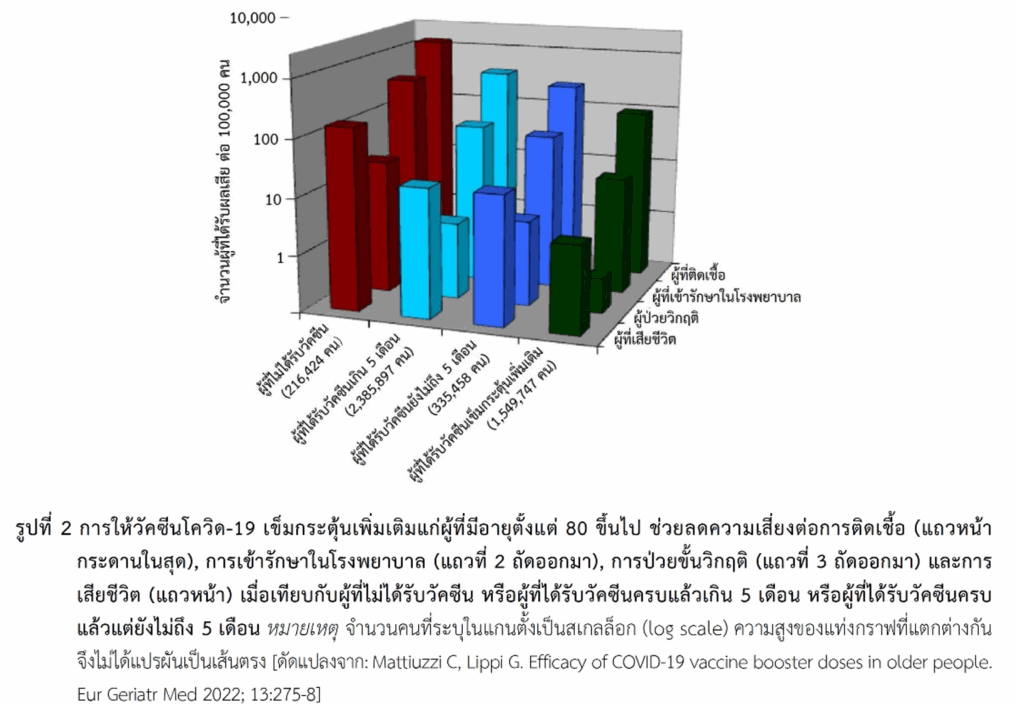
ในผู้สูงอายุ มีข้อมูลการศึกษาที่ประเทศอิตาลีในผู้ที่มีอายุตั้งแต่ 80 ปีขึ้นไปที่ได้รับการฉีดวัคซีนโควิด-19 ซึ่งมีทั้งแพลตฟอร์มชนิดเอ็มอาร์เอ ชนิดที่มีอะดีโนไวรัสเป็นพาหะ และชนิดอื่น (ประมาณ 87% เป็นชนิดเอ็มอาร์เอ) แบ่งผู้สูงอายุเป็นกลุ่มที่ไม่ได้รับวัคซีน (216,424 คน), กลุ่มที่ได้รับวัคซีนครบแล้วในช่วงไม่ถึง 5 เดือน (335,458 คน), กลุ่มที่ได้รับวัคซีนครบแล้วตั้งแต่ 5 เดือนขึ้นไป (2,385,897 คน) และผู้ที่ได้รับวัคซีนเข็มกระตุ้นเพิ่มเติมอีก (บูสเตอร์เพิ่ม) หลังจากได้รับครบแล้ว (1,549,747 คน) ผลการศึกษาพบว่าผู้ที่ได้รับวัคซีนครบแล้วในช่วงไม่เกิน 5 เดือนช่วยลดการติดเชื้อได้ 80%, ลดการเข้ารักษาในโรงพยาบาลและการเข้าแผนกผู้ป่วยหนักได้ 86% และลดการเสียชีวิตได้ 88% เมื่อเปรียบเทียบกับกลุ่มที่ไม่ได้รับวัคซีนเลย และการให้บูสเตอร์เพิ่มช่วยป้องกันโรคได้เพิ่มขึ้น โดยเมื่อเปรียบเทียบกับกลุ่มที่ได้รับวัคซีนครบแล้วตั้งแต่ 5 เดือนขึ้นไปพบว่ากลุ่มที่ได้บูสเตอร์เพิ่มช่วยลดความเสี่ยงต่อการติดเชื้อได้ 75%, ลดการเข้ารักษาในโรงพยาบาลและการเข้าแผนกผู้ป่วยหนักได้ 82–83% และลดการเสียชีวิตได้ 81% และหากเปรียบเทียบกับกลุ่มที่ได้รับวัคซีนครบแล้วในช่วงไม่ถึง 5 เดือนพบว่าการให้บูสเตอร์เพิ่มช่วยป้องกันโรค (ประเมินทุกปัจจัยข้างต้น) ได้สูงกว่าโดยมีค่าอยู่ในช่วง 63-87% (รูปที่ 2)
 ภูมิคุ้มกันลูกผสมหรือภูมิคุ้มกันไฮบริด (hybrid immunity) เสริมฤทธิ์กระตุ้นภูมิคุ้มกัน
ภูมิคุ้มกันลูกผสมหรือภูมิคุ้มกันไฮบริด (hybrid immunity) เสริมฤทธิ์กระตุ้นภูมิคุ้มกัน
การติดเชื้อไวรัสโควิด-19 มาแล้วและได้รับวัคซีน หรือผู้ที่เกิดการติดเชื้อภายหลังได้รับวัคซีน จะเกิดการเสริมฤทธิ์กระตุ้นภูมิคุ้มกันเกิดเป็น “ภูมิคุ้มกันลูกผสมหรือภูมิคุ้มกันไฮบริด (hybrid immunity)” มีการศึกษาในผู้ที่เคยติดเชื้อไวรัสโควิด-19 มาแล้วและได้รับวัคซีนพบว่ามีการกระตุ้นระบบภูมิคุ้มกันให้ทำงานได้ดีขึ้นและอยู่นานขึ้นเกินกว่า 1 ปีหลังการติดเชื้อ จนมีผู้เรียกว่า “super immunity” มีการคาดหวังว่าภูมิคุ้มกันลูกผสมจะช่วยต่อสู้กับเชื้อกลายพันธุ์ได้ดีขึ้นด้วย อย่างไรก็ตามยังคงต้องรอผลการศึกษาเพิ่มเติม
ปัจจัยที่ส่งผลกระทบต่อประสิทธิผลของวัคซีนโควิด-19
จากข้อมูลที่มีอยู่ขณะนี้มีปัจจัยหลายอย่างที่ส่งผลกระทบต่อประสิทธิผลของวัคซีนโควิด-19 ดังกล่าวข้างล่างนี้
- ชนิดของวัคซีน พบว่าวัคซีนชนิดที่มีแพลตฟอร์มเป็นเอ็มอาร์เอให้ประสิทธิผลในการป้องกันโรคโดยรวม เมื่อประเมินในด้านป้องกันการติดเชื้อ ป้องกันการป่วย หรือป้องกันการป่วยรุนแรง ได้สูงกว่าชนิดที่มีอะดีโนไวรัสเป็นพาหะ
- ระยะเวลาหลังฉีดวัคซีน ไม่ว่าวัคซีนที่มีแพลตฟอร์มชนิดใดให้ประสิทธิผลลดลงมากหลังจากได้รับวัคซีนครบแล้วราว 4-6 เดือน
- การกลายพันธุ์ของไวรัสก่อโรค ทำให้ประสิทธิผลของวัคซีนที่ใช้อยู่ขณะนี้ซึ่งผลิตบนพื้นฐานเพื่อการป้องกันไวรัสสายพันธุ์ดั้งเดิมนั้นลดลง
- การตอบสนองของแต่ละคน เนื่องจากมีความหลากหลายด้านพันธุกรรม อายุ เพศ น้ำหนักตัว สุขภาพทางกายและจิตใจ เป็นต้น ความหลากหลายเหล่านี้อาจส่งผลกระทบต่อประสิทธิผลของวัคซีน อย่างไรก็ตามในด้านที่เกี่ยวกับอายุนั้น ข้อมูลจากการศึกษาที่ผ่านมาพบว่าประสิทธิผลของวัคซีนในเด็ก คนหนุ่มสาว และผู้สูงอายุ ถือได้ว่าไม่แตกต่างกันไม่ว่าจะประเมินด้านป้องกันการติดเชื้อ ป้องกันการป่วย หรือป้องกันการป่วยรุนแรง
- จำนวนวัคซีนที่ให้บูสเตอร์ พบว่าการให้บูสเตอร์เพิ่มเติมในช่วงเวลาที่เหมาะสมภายหลังได้รับวัคซีนครบแล้วจะช่วยเพิ่มประสิทธิผลในการป้องกันโรค ไม่ว่าจะประเมินด้วยการป้องกันการติดเชื้อ การป้องกันการป่วย หรือการป้องกันการป่วยรุนแรง โดยเฉพาะในผู้สูงอายุ อย่างไรก็ตามขณะนี้ยังไม่มีความชัดเจนว่าภูมิคุ้มกันต่อโรคจะเพิ่มขึ้นตามจำนวนครั้งที่ให้บูสเตอร์หรือไม่ มีข้อมูลเพียงว่าการฉีดเข็มที่ 3 ช่วยเพิ่มการป้องกันโรค ข้อมูลเกี่ยวกับการฉีดเข็มที่ 4 ยังมีน้อย
- ผู้ที่เคยติดเชื้อมาแล้วและได้รับวัคซีน หรือผู้ที่เกิดการติดเชื้อภายหลังได้รับวัคซีน ทำให้เกิดภูมิคุ้มกันลูกผสมหรือภูมิคุ้มกันไฮบริดซึ่งจะเสริมฤทธิ์กระตุ้นภูมิคุ้มกันดังกล่าวแล้วข้างต้น ซึ่งจะช่วยเพิ่มประสิทธิผลในการป้องกันโรค
- ปัจจัยอื่น เช่น การใช้ยาที่ส่งผลรบกวนฤทธิ์กระตุ้นการสร้างภูมิคุ้มกันของวัคซีน (ตัวอย่างเช่น ยาต้านการอักเสบ, ยากดภูมิคุ้มกัน ซึ่งใช้รักษาโรคภูมิต้านตนเองชนิดต่าง ๆ), การเป็นโรคบางอย่าง (ตัวอย่างเช่น โรคภูมิคุ้มกันบกพร่อง, โรคไตระยะสุดท้าย, โรคมะเร็งบางชนิด)
เอกสารอ้างอิง
- Hodgson SH, Mansatta K, Mallett G, Harris V, Emary KRW, Pollard AJ. What defines an efficacious COVID-19 vaccine? A review of the challenges assessing the clinical efficacy of vaccines against SARS-CoV-2. Lancet Infect Dis 2021;21(2):e26-e35.
- Olliaro P. What does 95% COVID-19 vaccine efficacy really mean? Lancet Infect Dis. 2021; 21:769.
- U.S. Department Of Health And Human Services. Lesson 3: Measures of risk/Section 6: Measures of public health impact: vaccine efficacy or vaccine effectiveness, last reviewed: May 18, 2012. https://www.cdc.gov/csels/dsepd/ss1978/lesson3/section6.html. Accessed: April 12, 2022.
- Feikin DR, Higdon MM, Abu-Raddad LJ, Andrews N, Araos R, Goldberg Y, et al. Duration of effectiveness of vaccines against SARS-CoV-2 infection and COVID-19 disease: results of a systematic review and meta-regression. Lancet 2022; 399:924-44.
- Fiolet T, Kherabi Y, MacDonald CJ, Ghosn J, Peiffer-Smadja N. Comparing COVID-19 vaccines for their characteristics, efficacy and effectiveness against SARS-CoV-2 and variants of concern: a narrative review. Clin Microbiol Infect 2022; 28:202-21.
- Tenforde MW, Self WH, Gaglani M, Ginde AA, Douin DJ, Talbot HK, et al. Effectiveness of mRNA vaccination in preventing COVID-19-associated invasive mechanical ventilation and death - United States, March 2021-January 2022. MMWR Morb Mortal Wkly Rep 2022; 71:459-65.
- Zheng C, Shao W, Chen X, Zhang B, Wang G, Zhang W. Real-world effectiveness of COVID-19 vaccines: a literature review and meta-analysis. Int J Infect Dis 2022; 114:252-60.
- Ioannou GN, Locke ER, O'Hare AM, Bohnert ASB, Boyko EJ, Hynes DM, et al. COVID-19 vaccination effectiveness against infection or death in a National U.S. Health Care System: a target trial emulation study. Ann Intern Med 2022; 175:352-61.
- Huang Z, Su Y, Zhang T, Xia N. A review of the safety and efficacy of current COVID-19 vaccines. Front Med 2022; 16:39-55.
- Mistry P, Barmania F, Mellet J, Peta K, Strydom A, Viljoen IM, et al. SARS-CoV-2 variants, vaccines, and host immunity. Front Immunol 2022. doi: 10.3389/fimmu.2021.809244. Accessed: April 12, 2022.
- Aleem A, Akbar Samad AB, Slenker AK. Emerging variants of SARS-CoV-2 and novel therapeutics against coronavirus (COVID-19), updated February 6, 2022. In: StatPearls. Treasure Island (FL): StatPearls Publishing; 2022 Jan–. Accessed: April 12, 2022.
- Priyanka, Choudhary OP. Vaccine efficacy against COVID-19: a foresight on the host-associated factors. J Formos Med Assoc 2021; 120:1405-7.
- Falahi S, Kenarkoohi A. Host factors and vaccine efficacy: implications for COVID-19 vaccines. J Med Virol 2022; 94:1330-5.
- Ao D, Lan T, He X, Liu J, Chen L, Baptista-Hon DT, et al. SARS-CoV-2 Omicron variant: immune escape and vaccine development. MedComm 2022. doi: 10.1002/mco2.126. Accessed: April 12, 2022.
- Bian L, Gao F, Zhang J, He Q, Mao Q, Xu M, Liang Z. Effects of SARS-CoV-2 variants on vaccine efficacy and response strategies. Expert Rev Vaccines 2021; 20:365-73.
- Accorsi EK, Britton A, Fleming-Dutra KE, Smith ZR, Shang N, Derado G, et al. Association between 3 doses of mRNA COVID-19 vaccine and symptomatic infection caused by the SARS-CoV-2 Omicron and Delta variants. JAMA 2022; 327:639-51.
- Turner JS, Kim W, Kalaidina E, Goss CW, Rauseo AM, Schmitz AJ, et al. SARS-CoV-2 infection induces long-lived bone marrow plasma cells in humans. Nature 2021; 595:421-5.
- Giannotta G, Giannotta N. mRNA COVID-19 vaccines and long-lived plasma cells: a complicated relationship. Vaccines 2021. doi: 10.3390/vaccines9121503. Accessed: April 12, 2022.
- Hall V, Foulkes S, Insalata F, Kirwan P, Saei A, Atti A, et al. Protection against SARS-CoV-2 after Covid-19 vaccination and previous infection. N Engl J Med 2022; 386:1207-20.
- Lipsitch M, Krammer F, Regev-Yochay G, Lustig Y, Balicer RD. SARS-CoV-2 breakthrough infections in vaccinated individuals: measurement, causes and impact. Nat Rev Immunol 2022; 22:57-65.
- Pilz S, Theiler-Schwetz V, Trummer C, Krause R, Ioannidis JPA. SARS-CoV-2 reinfections: overview of efficacy and duration of natural and hybrid immunity. Environ Res 2022. doi: 10.1016/j.envres.2022.112911. Accessed: April 12, 2022.
- Mattiuzzi C, Lippi G. Efficacy of COVID-19 vaccine booster doses in older people. Eur Geriatr Med 2022; 13:275-8.