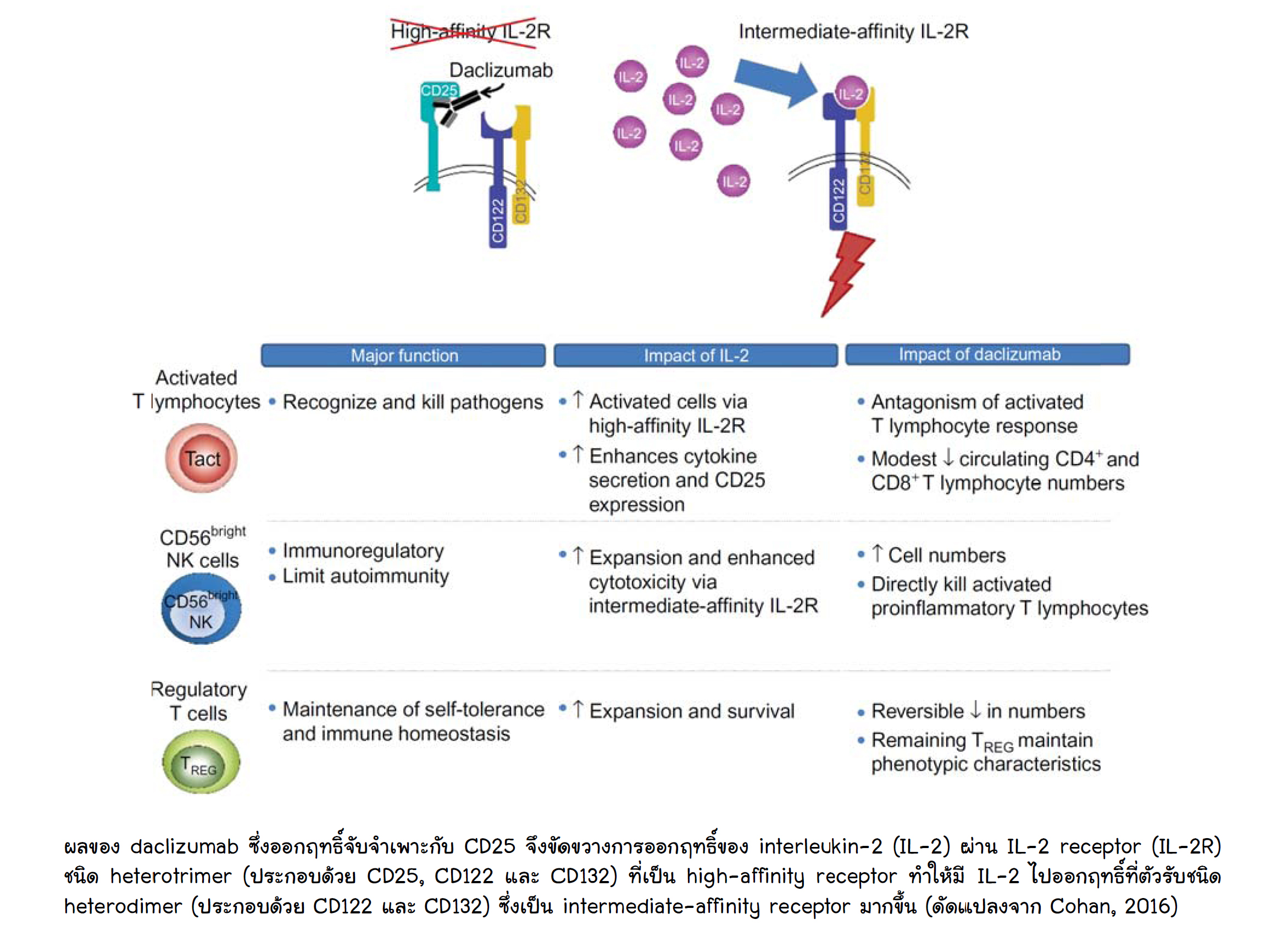
Daclizumab เป็น humanized monoclonal antibody ที่จับจำเพาะกับ alpha subunit ของ interleukin-2 receptor (IL-2Rα หรือ CD25) เป็นยากดภูมิคุ้มกัน (immunosuppressive) ยานี้มีจำหน่ายแล้วในข้อบ่งใช้สำหรับป้องกันการปฏิเสธเนื้อเยื่อไตที่ปลูกถ่ายโดยใช้ร่วมกับยากดภูมิคุ้มกันชนิดอื่นได้แก่ cyclosporine และ corticosteroid เมื่อเร็วๆ นี้ได้รับข้อบ่งใช้ใหม่สำหรับรักษาโรค multiple sclerosis (MS) ในผู้ใหญ่ที่ผ่านการใช้ยารักษา MS ชนิดอื่นมาแล้วไม่น้อยกว่า 2 ชนิด การที่ยานี้ออกฤทธิ์จับจำเพาะกับ CD25 จึงยับยั้งฤทธิ์ IL-2 เฉพาะที่ออกฤทธิ์ผ่านตัวรับชนิด heterotrimer (ประกอบด้วย CD25, CD122 และ CD132) ซึ่งพบที่ activated T lymphocytes และเซลล์อื่นในระบบภูมิคุ้มกัน (ดูข้อมูลเพิ่มเติมได้ในเรื่อง “CD25…เป้าหมายของยารักษา multiple sclerosis” ใน “ข่าวยา” ประจำสัปดาห์ที่ 2 เดือน กันยายน ปี 2559) จึงลด proinflammatory response (ดูรูป) ยานี้ไม่รบกวน IL-2 ที่ออกฤทธิ์ผ่านตัวรับชนิด heterodimer (ประกอบด้วย CD122 และ CD132) และยังทำให้ IL-2 ออกฤทธิ์ที่ตัวรับชนิดนี้มากขึ้นอีกด้วย ยานี้ผลิตออกจำหน่ายในรูปยาน้ำสำหรับฉีดเข้าใต้ผิวหนัง บรรจุในหลอดยาฉีดสำหรับการให้ครั้งเดียว (single-dose prefilled syringe) ปริมาตร 1 มิลลิลิตร มีตัวยา 150 มิลลิกรัม ขนาดยาที่ใช้คือ 150 มิลลิกรัม ฉีดเข้าใต้ผิวหนังเดือนละ 1 ครั้ง (ต่างจากการใช้เพื่อป้องกันการปฏิเสธเนื้อเยื่อไตที่ปลูกถ่ายซึ่งเป็นยาน้ำใสสำหรับให้เข้าหลอดเลือดดำ บรรจุในขวดยาสำหรับการใช้ครั้งเดียว ในปริมาตร 5 มิลลิลิตรมีตัวยา 25 มิลลิกรัม ใช้ในขนาด 1.0 มิลลิกรัมต่อน้ำหนักตัว 1 กิโลกรัม)
การที่ daclizumab ได้รับอนุมัติในข้อบ่งใช้สำหรับโรค MS เนื่องจากมีการศึกษาทางคลินิกสนับสนุนจำนวน 2 ศึกษา (Study 1 และ Study 2) เป็นการศึกษาแบบ randomized, double-blind, controlled trial เพื่อเปรียบเทียบการใช้ยานี้ในขนาด 150 มิลลิกรัม ฉีดเข้าใต้ผิวหนังทุก 4 สัปดาห์ ในผู้ป่วย relapsing multiple sclerosis (RMS) ใน Study 1 เปรียบเทียบกับยารักษา MS ชนิดอื่น (active-controlled trial) คือ interferon beta-1a (IFNß-1a) ขนาด 30 ไมโครกรัม ฉีดเข้ากล้ามเนื้อทุกสัปดาห์ ศึกษาในผู้ป่วย 1,841 คนที่ผ่านการใช้ยารักษา MS มาแล้ว ได้รับ daclizumab (919 คน) หรือ IFNß-1a (922 คน) ศึกษาเป็นเวลา 144 สัปดาห์ (จนกระทั่งผู้ป่วยคนสุดท้ายที่เข้าร่วมการศึกษาได้รับยาครบ 96 สัปดาห์) ประเมินผลทางคลินิกด้วย annualized relapse rate (ARR) ทุก 12 สัปดาห์และภายหลังที่กลับมามีอาการ และทำ MRI scan สัปดาห์ที่ 24 และ 96 พบว่า daclizumab ให้ผลดีกว่า IFNß-1a ในการลด ARR (relative reduction 45%, p < 0.001 จนถึงสัปดาห์ที่ 144) และลดจำนวน T2 hyperintense lesions ที่พบใหม่หรือขนาดโตขึ้น (relative reduction 54%, p < 0.001 ในสัปดาห์ที่ 96) ส่วน Study 2 เปรียบเทียบกับยาหลอก ศึกษาในผู้ป่วย 412 คนที่ผ่านการใช้ยารักษา MS มาแล้ว ได้รับ daclizumab (208 คน) หรือยาหลอก (204 คน) ศึกษาเป็นเวลา 52 สัปดาห์ ประเมินผลทางคลินิกด้วย ARR ทุก 12 สัปดาห์และภายหลังที่กลับมามีอาการ และทำ MRI scan สัปดาห์ที่ 24, 36, และ 52 ในสัปดาห์ที่ 52 พบว่า daclizumab ให้ผลดีกว่ายาหลอกในการลด ARR (relative reduction 54%, p < 0.001 ในสัปดาห์ที่ 52) ลดจำนวน T2 hyperintense lesions ที่พบใหม่หรือขนาดโตขึ้น (relative reduction 70%, p < 0.001 ในสัปดาห์ที่ 52) และลดจำนวน T1 Gd-enhancing lesions ที่พบใหม่ (relative reduction 69%, p < 0.001 ระหว่างสัปดาห์ที่ 8-24) สำหรับอาการไม่พึงประสงค์ของ daclizumab ที่อาจพบ เช่น เกิดอันตรายต่อตับ (รวมถึง autoimmune hepatitis) เกิด immune-mediated disorders อื่นๆ แพ้ยา ติดเชื้อ ซึมเศร้าและคิดฆ่าตัวตาย
อ้างอิงจาก:
(1) Cohan S. Therapeutic efficacy of monthly subcutaneous injection of daclizumab in relapsing multiple sclerosis. Biologics 2016;10:119-38; (2) Daclizumab.
http://www.rxlist.com/zinbryta-drug.htm; (3) FDA News Release−FDA approves Zinbryta to treat multiple sclerosis.
http://www.fda.gov/NewsEvents/Newsroom/PressAnnouncements/ucm504000.htm

