โควิด-19 (COVID-19) เป็นโรคติดเชื้อที่ทางเดินหายใจ เกิดจากโคโรนาไวรัสสายพันธุ์ใหม่ คือ “2019-nCoV (2019 novel coronavirus)” หรือ “SARS-CoV-2” เริ่มเกิดการระบาดที่เมืองอู่ฮั่นในประเทศจีน (Wuhan, China) เมื่อเดือนธันวาคมปี พ.ศ. 2562 (ค.ศ. 2019) ปัจจุบันยังคงมีการระบาดในบางประเทศ ผู้ป่วยโควิด-19 มีอาการที่สำคัญคือ มีไข้ ไอ และหายใจลำบาก ขณะนี้ยังไม่มียาใดที่มีข้อบ่งใช้สำหรับรักษาโควิด-19 และไม่มีวัคซีนใช้ การรักษาจึงเป็นแบบประคับประคองอาการตามวิธีการรักษาที่เป็นมาตรฐาน แม้จะมีการนำยาบางชนิดที่ให้ผลการศึกษาในหลอดทดลองดีในการต้านไวรัสที่ก่อโรค (SARS-CoV-2) แต่การนำมาใช้รักษาผู้ป่วยยังให้ผลไม่ชัดเจน นอกจากนี้ในผู้ป่วยที่มีอาการรุนแรงพบว่าระดับไซโตไคน์ (cytokines) หลายชนิดในเลือดเพิ่มขึ้นอย่างมากซึ่งคาดว่าเกิด “พายุไซโตไคน์ (cytokine storm)” ไซโตไคน์เป็นสารที่สร้างและหลั่งโดยเซลล์ในระบบภูมิคุ้มกัน ไซโตไคน์หลายชนิดมีบทบาทในการก่อการอักเสบ ในช่วงที่มีการระบาดของโควิด-19 จึงนำยาต้านไซโตไคน์บางชนิดมาทดลองใช้รักษาเพื่อเป็นการช่วยชีวิตตามความจำเป็น (compassionate use) อย่างไรก็ตามผลการรักษายังไม่อาจสรุปได้ ยาบางชนิดดูเหมือนให้ผลดี แต่บางชนิดทำให้ผู้ป่วยบางรายมีอาการแย่ลง ขณะนี้หลายหน่วยงานกำลังเร่งทำการศึกษายาต้านไซโตไคน์ทั้งชนิดที่ใช้เป็นยารักษาโรคอื่นอยู่แล้วและยาใหม่ที่ยังไม่เคยวางจำหน่ายมาก่อน การศึกษาส่วนใหญ่เริ่มแล้วในช่วงเดือนเมษายน 2563 บางการศึกษาคาดว่าจะเริ่มประเมินผลเบื้องต้นได้ในเดือนมิถุนายน 2563 ในบทความนี้จะให้ข้อมูลทั่วไปเกี่ยวกับ “พายุไซโตไคน์”, “พายุไซโตไคน์” ในผู้ป่วยโควิด-19, ข้อควรคำนึงในการใช้ยาต้านไซโตไคน์ในการรักษาผู้ป่วยโควิด-19 และการศึกษาถึงการใช้ยาต้านไซโตไคน์รักษาผู้ป่วยโควิด-19
ข้อมูลทั่วไปเกี่ยวกับ “พายุไซโตไคน์” ไซโตไคน์เป็นสารที่สร้างและหลั่งโดยเซลล์ในระบบภูมิคุ้มกัน มีบทบาทเกี่ยวกับภูมิคุ้มกันและบทบาทด้านอื่นรวมถึงการเกิดการอักเสบ ซึ่งการอักเสบเป็นปฏิกิริยาการตอบสนองทางภูมิคุ้มกันอย่างหนึ่งของร่างกายในการต่อสู้กับสิ่งแปลกปลอม ตัวอย่างไซโตไคน์ เช่น อินเตอร์เฟียรอน-แกมมา (interferon-gamma หรือ IFN-γ), อินเตอร์ลิวคิน-1 (interleukin-1 หรือ IL-1), อินเตอร์ลิวคิน-6 (interleukin-6 หรือ IL-6), ทีเอนเอฟ-แอลฟา (tumor necrosis factor-alpha หรือ TNF-α) แม้ว่าไซโตไคน์เหล่านี้จะมีบทบาทในการตอบสนองทางภูมิคุ้มกันตามปกติเมื่อมีแปลกปลอมมากระตุ้น แต่บางกรณีร่างกายมีปฏิกิริยาตอบสนองที่รุนแรงหรือมากเกินไปทำให้มีการหลั่งไซโตไคน์หลายชนิดสู่กระแสเลือดทันทีพร้อมกันในปริมาณมาก (hypercytokinemia) จะทำให้เกิด “พายุไซโตไคน์” และเป็นอันตรายได้ พายุไซโตไคน์เกิดได้จากหลายสาเหตุ เช่น การติดเชื้อ (รวมถึงไวรัสโควิด-19), ภาวะภูมิต้านตนเอง, การรักษาโรคมะเร็งด้วยอิมมูโนรีเซพเตอร์ (chimeric antigen receptor T-cell therapy หรือ CAR T-cell therapy) กลุ่มอาการที่เกิดขึ้นจากพายุไซโตไคน์มีหลายอย่าง เช่น ไข้สูง คลื่นไส้ อาการอ่อนล้ามาก การอักเสบของอวัยวะบางแห่งซึ่งอาจรุนแรงจนทำให้อวัยวะนั้นทำงานล้มเหลว กลุ่มอาการดังกล่าวอาจเกิดแตกต่างกันได้ตามสาเหตุที่ทำให้เกิดพายุไซโตไคน์ เนื่องจากสาเหตุที่ต่างกันอาจส่งผลในการกระตุ้นการหลั่งไซโตไคน์ต่างชนิดกันและในปริมาณที่ต่างกัน
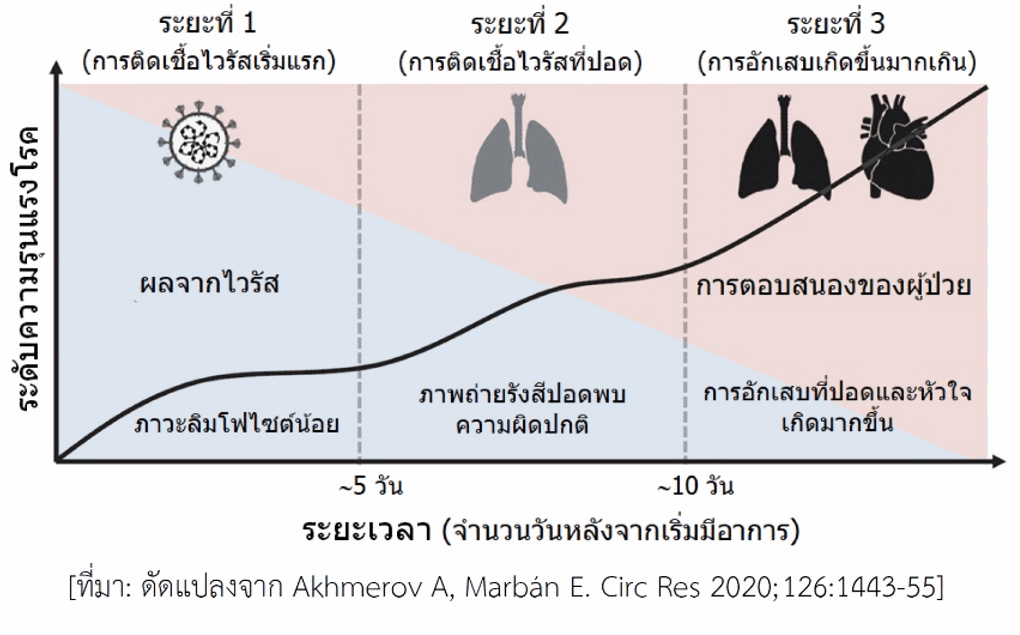
ภาวะพายุไซโตไคน์ในผู้ป่วยโควิด-19 ผู้ป่วยโควิด-19 มีอาการที่สำคัญคือ มีไข้ ไอ และหายใจลำบาก หากเป็นไม่รุนแรงภายหลังได้รับการรักษาแบบประคับประคองอาการตามวิธีการรักษาที่เป็นมาตรฐานจะดีขึ้นและสามารถกลับบ้านได้ ส่วนผู้ที่มีอาการปานกลางโดยเฉพาะผู้สูงอายุหรือมีโรคอื่นอยู่แล้วหรือเริ่มเกิดโรคแทรกซ้อน หลังพ้นสัปดาห์แรกไปแล้วอาจมีอาการรุนแรงขึ้น แม้ว่าขณะนี้ยังไม่มีตัวชี้วัดที่ชัดเจนและมีประสิทธิภาพดีพอที่จะประเมินระดับความรุนแรงของโรค อย่างไรก็ตามพบว่าในช่วงแรกจะเกิดภาวะเม็ดเลือดขาวชนิดลิมโฟไซต์น้อยในเลือด (lymphocytopenia) ซึ่งจะรุนแรงมากขึ้นตามอาการ ประมาณว่ามีผู้ป่วยราว 5% เข้าสู่ขั้นวิกฤติ ผลตรวจทางห้องปฏิบัติการพบสิ่งบ่งชี้ถึงการเกิดภาวะอักเสบของอวัยวะอย่างรุนแรง เช่น ที่ปอด หัวใจ (ดูรูป) ในเลือดพบค่าผิดปกติหลายอย่าง เช่น เฟอร์ริติน (ferritin) เพิ่มขึ้น เกล็ดเลือดลดลง ระดับเอนไซม์หลายชนิดสูงขึ้น บางรายพบระดับไซโตไคน์หลายชนิดในเลือดสูงผิดปกติซึ่งแสดงถึงการเกิดพายุไซโตไคน์ ไซโตไคน์ที่พบมีทั้งชนิดก่อการอักเสบและชนิดต้านการอักเสบ สำหรับชนิดที่ก่อการอักเสบมีหลายชนิด รวมถึงอินเตอร์ลิวคิน-1, อินเตอร์ลิวคิน-6, ทีเอนเอฟ-แอลฟา ซึ่งไซโตไคน์เหล่านี้พบได้ในโรคภูมิต้านตนเอง เช่น โรคข้ออักเสบรูมาตอยด์ นอกจากนี้ยังพบไวรัสที่อวัยวะอื่นนอกเหนือจากปอด เช่น หัวใจและหลอดเลือด ไต ทางเดินอาหาร สมอง สิ่งที่ตรวจพบข้างต้นสอดคล้องกับอาการของผู้ป่วยระยะรุนแรง เช่น เกิดกลุ่มอาการหายใจลำบากเฉียบพลัน (acute respiratory distress syndrome), การทำงานของหัวใจล้มเหลว, ภาวะช็อกจากการติดเชื้อ, การแข็งตัวของเลือดผิดปกติ เกิดจับก้อนง่ายและอุดหลอดเลือดที่อวัยวะต่าง ๆ ทำให้อวัยวะหลายอย่างทำงานล้มเหลว, อาจมีอาการทางระบบประสาทส่วนกลาง (เช่น อาการชัก)
 ข้อควรคำนึงในการใช้ยาต้านไซโตไคน์ในการรักษาผู้ป่วยโควิด-19
ข้อควรคำนึงในการใช้ยาต้านไซโตไคน์ในการรักษาผู้ป่วยโควิด-19 ในการนำยาต้านไซโตไคน์มาใช้รักษาผู้ป่วยโควิด-19 มีข้อควรคำนึงหลายอย่างดังนี้ (1) ไซโตไคน์มีบทบาทในปฏิกิริยาการตอบสนองทางภูมิคุ้มกันของร่างกาย ซึ่งการอักเสบเป็นปฏิกิริยาทางภูมิคุ้มกันอย่างหนึ่งในการต่อสู้กับสิ่งแปลกปลอม ด้วยเหตุนี้การใช้ยาต้านไซโตไคน์ (ดูตัวอย่างชื่อยาในหัวข้อ
“การศึกษาถึงการใช้ยาต้านไซโตไคน์รักษาผู้ป่วยโควิด-19”) แม้จะช่วยลดการอักเสบของอวัยวะได้ แต่ส่งผลกระทบต่อการกำจัดไวรัสซึ่งต้องอาศัยการทำงานของระบบภูมิคุ้มกันเป็นหลัก ผู้ป่วยอาจมีอาการรุนแรงขึ้นเนื่องจากไวรัสมีจำนวนเพิ่มขึ้น ประกอบกับขณะนี้ยังไม่มียาที่มีประสิทธิภาพดีในการกำจัดไวรัสโควิด-19, (2) พายุไซโตไคน์ที่เกิดขึ้นมีการหลั่งไซโตไคน์หลายชนิดและรูปแบบการหลั่ง (ทั้งชนิดและปริมาณ) ในผู้ป่วยแต่ละรายอาจแตกต่างกันได้ การใช้ยาต้านไซโตไคน์ซึ่งออกฤทธิ์เจาะจงต่อไซโตไคน์ชนิดใดชนิดหนึ่งจึงอาจให้ผลดีเฉพาะกับผู้ป่วยบางราย, (3) การพบไวรัสที่อวัยวะอื่นนอกเหนือจากปอด (เช่น ไต หัวใจ) ดังที่กล่าวข้างต้น และที่อวัยวะเหล่านั้นพบตัวรับเอซีอี 2 (angiotensin-converting enzyme 2 หรือ ACE2) ซึ่งเป็นช่องทางที่ไวรัสโควิด-19 ใช้เพื่อเข้าสู่ภายในเซลล์ จึงเป็นไปได้ว่าความรุนแรงที่เกิดขึ้นจนผู้ป่วยเสียชีวิตไม่ได้เป็นเพราะพายุไซโตไคน์เท่านั้น อาจเกิดจากไวรัสเอง ที่ผ่านมาภาวะหัวใจล้มเหลวและภาวะไตวายเป็นส่วนหนึ่งของการเสียชีวิตในผู้ป่วยโควิด-19 และ (4) ยาที่มีฤทธิ์ยับยั้งเอนไซม์เจนัสไคเนส (Janus kinase หรือ JAK) (ชื่อยามีกล่าวต่อไป) จะรบกวนประสิทธิภาพของอินเตอร์เฟียรอนในการออกฤทธิ์ต้านไวรัสซึ่งต้องอาศัยเอนไซม์นี้ (ผ่านทาง JAK–STAT signaling pathway) ด้วยเหตุนี้การใช้ยาต้านไซโตไคน์อาจไม่ได้รับประโยชน์เท่าที่ควร
การศึกษาถึงการใช้ยาต้านไซโตไคน์รักษาผู้ป่วยโควิด-19 ในช่วงที่มีการระบาดของโควิด-19 ได้นำยาต้านไซโตไคน์บางชนิดมาทดลองใช้รักษาผู้ป่วยเพื่อเป็นการช่วยชีวิตตามความจำเป็น ซึ่งผลการรักษายังไม่อาจสรุปได้ ขณะนี้หลายหน่วยงานกำลังเร่งทำการศึกษายาต้านไซโตไคน์ทั้งชนิดที่ใช้เป็นยารักษาโรคอื่นอยู่แล้วและยาใหม่ที่ยังไม่เคยวางจำหน่ายมาก่อน สำหรับยาที่มีใช้อยู่แล้วส่วนใหญ่เป็นยารักษาโรคข้ออักเสบรูมาตอยด์ เช่น อะนาคินรา (anakinra), โทซิลิซูแมบ (tocilizumab), ซาริลูแมบ (sarilumab), อะดาลิมูแมบ (adalimumab), โทฟาซิทินิบ (tofacitinib), บาริซิทินิบ (baricitinib) ส่วนยาที่ใช้ในโรคอื่น (นอกเหนือจากโรคข้ออักเสบรูมาตอยด์) หรือยาใหม่ที่นำมาศึกษามีหลายชนิดเช่นกัน ตัวอย่างเช่น ซิลทูซิแมบ (siltuximab), รูโซลิทินิบ (ruxolitinib), แคนาคินูแมบ (canakinumab), มาวริลิมูแมบ (mavrilimumab) การศึกษาส่วนใหญ่เริ่มต้นช่วงเดือนเมษายน 2563 ซึ่งเป็นช่วงที่ยังสามารถหาผู้ป่วยเข้าร่วมโครงการได้เป็นจำนวนมาก และบางการศึกษาจะเริ่มประเมินผลเบื้องต้นได้ในเดือนมิถุนายน 2563 ดังตัวอย่างยาและการศึกษาที่กล่าวถึงข้างล่างนี้
โทซิลิซูแมบ (ชื่อการค้าคือ Actemra และ RoActemra ยานี้เป็น humanized IL-6 receptor monoclonal antibody) เป็นยาต้านอินเตอร์ลิวคิน-6 ในการศึกษามีการแบ่งกลุ่มผู้ป่วยแบบสุ่ม ปกปิดชื่อยาและมีกลุ่มยาหลอกเพื่อเปรียบเทียบ (randomized, double-blind, placebo-controlled trial) เป็นการศึกษาทางคลินิกระยะที่ 3 (phase 3 clinical study) ที่ทำร่วมกันหลายหน่วยงานในประเทศสหรัฐอเมริกา แคนาดา และอีกหลายประเทศในยุโรป เพื่อประเมินประสิทธิภาพและความปลอดภัย (รวมถึงศึกษาด้านเภสัชพลศาสตร์และเภสัชจลนศาสตร์) ของยาโทซิลิซูแมบในการรักษาโรคปอดอักเสบรุนแรงจากโควิด-19 ในผู้ป่วยจำนวน 330 คน อายุตั้งแต่ 18 ปีขึ้นไป ผู้ป่วยทุกรายได้รับการรักษาแบบประคับประคองอาการตามวิธีการรักษาที่เป็นมาตรฐาน ขนาดยาที่ให้คือ 8 มิลลิกรัมต่อน้ำหนักตัว 1 กิโลกรัม (สูงสุดไม่เกิน 800 มิลลิกรัม) โดยการหยดเข้าหลอดเลือดดำ หากอาการไม่ดีขึ้นหรือแย่ลงสามารถให้ยาได้อีกไม่เกิน 1 ครั้ง การศึกษานี้เริ่มเมื่อต้นเดือนเมษายน 2563 กำหนดประเมินผลเบื้องต้นสิ้นเดือนสิงหาคม 2563 และคาดว่าจะเสร็จสมบูรณ์สิ้นเดือนกันยายน 2563
รูโซลิทินิบ (ชื่อการค้าคือ Jakafi ยานี้เป็น Janus kinase inhibitor ชนิด JAK1/JAK2 inhibitor) เป็นยายับยั้งเอนไซม์เจนัสไคเนสซึ่งเอนไซม์นี้ทำงานเกี่ยวข้องกับตัวรับของไซโตไคน์ ในการศึกษามีการเปิดเผยชื่อยาและไม่มีการเปรียบเทียบกับยาใด (single arm open-label clinical trial) เป็นการศึกษาทางคลินิกระยะที่ 3 ทำในประเทศแคนาดา เพื่อประเมินประสิทธิภาพและความปลอดภัยของยารูโซลิทินิบในการรักษาโรคปอดอักเสบจากโควิด-19 ในผู้ป่วยจำนวน 64 คน อายุตั้งแต่ 12 ปีขึ้นไป ผู้ป่วยทุกรายได้รับการรักษาแบบประคับประคองอาการตามวิธีการรักษาที่เป็นมาตรฐาน ขนาดยาที่ให้คือ 10 มิลลิกรัม รับประทานวันละ 2 ครั้ง เป็นเวลา 14 วัน ตามด้วยขนาด 5 มิลลิกรัม วันละ 2 ครั้ง เป็นเวลา 2 วัน และขนาด 5 มิลลิกรัม วันละ 1 ครั้ง เป็นเวลา 1 วัน การศึกษานี้เริ่มเมื่อพ้นกลางเดือนเมษายน 2563 กำหนดประเมินผลเบื้องต้นสิ้นเดือนตุลาคม 2563 และคาดว่าจะเสร็จสมบูรณ์สิ้นเดือนมกราคม 2564
โทฟาซิทินิบ (ชื่อการค้าคือ Xeljanz ยานี้เป็น Janus kinase inhibitor ชนิด JAK1/JAK3 inhibitor) เป็นยายับยั้งเอนไซม์เจนัสไคเนสซึ่งเอนไซม์นี้ทำงานเกี่ยวข้องกับตัวรับของไซโตไคน์ ในการศึกษามีการเปิดเผยชื่อยาและไม่มีการเปรียบเทียบกับยาใด (prospective single cohort open trial) เป็นการศึกษาทางคลินิกระยะที่ 2 เพื่อประเมินประสิทธิภาพและความปลอดภัยของยาโทฟาซิทินิบ ในการรักษาโรคปอดอักเสบจากโควิด-19 ระยะเริ่มเป็น ในผู้ป่วยจำนวน 50 คน อายุ 18-65 ปี ผู้ป่วยทุกรายได้รับการรักษาแบบประคับประคองอาการตามวิธีการรักษาที่เป็นมาตรฐาน ขนาดยาที่ให้คือ 10 มิลลิกรัม รับประทานวันละ 2 ครั้ง เป็นเวลา 14 วัน การศึกษานี้เริ่มต้นก่อนกลางเดือนเมษายน 2563 กำหนดประเมินผลเบื้องต้นหลังพ้นกลางเดือนมิถุนายน 2563 และคาดว่าจะเสร็จสมบูรณ์ก่อนกลางเดือนกรกฎาคม 2563
เอกสารอ้างอิง - Ye Q, Wang B, Mao J. The pathogenesis and treatment of the 'cytokine storm' in COVID-19. J Infect 2020. doi:10.1016/j.jinf.2020.03.037. Accessed: May 12, 2020.
- Akhmerov A, Marbán E. COVID-19 and the Heart. Circ Res 2020. doi:10.1161/circresaha.120.317055. Accessed: May 12, 2020.
- Zhang C, Wu Z, Li JW, Zhao H, Wang GQ. The cytokine release syndrome (CRS) of severe COVID-19 and Interleukin-6 receptor (IL-6R) antagonist tocilizumab may be the key to reduce the mortality. Int J Antimicrob Agents 2020. doi:10.1016/j.ijantimicag.2020.105954. Accessed: May 12, 2020.
- Mehta P, McAuley DF, Brown M, Sanchez E, Tattersall RS, Manson JJ. COVID-19: consider cytokine storm syndromes and immunosuppression. Lancet 2020; 395:1033-4.
- Sarzi-Puttini P, Giorgi V, Sirotti S, Marotto D, Ardizzone S, Rizzardini G, et al. COVID-19, cytokines and immunosuppression: what can we learn from severe acute respiratory syndrome? Clin Exp Rheumatol 2020; 38:337-42.
- Conti P, Ronconi G, Caraffa A, Gallenga CE, Ross R, Frydas I, et al. Induction of pro-inflammatory cytokines (IL-1 and IL-6) and lung inflammation by Coronavirus-19 (COVI-19 or SARS-CoV-2): anti-inflammatory strategies. J Biol Regul Homeost Agents 2020. doi:10.23812/CONTI-E. Accessed: May 12, 2020.
- Moore JB, June CH. Cytokine release syndrome in severe COVID-19. Science 2020; 368:473-4.
- Diamanti AP, Rosado MM, Pioli C, Sesti G, Laganà B. Cytokine release syndrome in COVID-19 patients, a new scenario for an old concern: the fragile balance between infections and autoimmunity. Int J Mol Sci 2020. doi:10.3390/ijms21093330. Accessed: May 12, 2020.
- Benucci M, Damiani A, Infantino M, Manfredi M, Quartuccio L. Old and new antirheumatic drugs for the treatment of COVID-19. Joint Bone Spine 2020; 87:195-7.
- Kupferschmidt K, Cohen J. Race to find COVID-19 treatments accelerates. Science 2020; 367:1412-3.
- Mountfort K. Treatments for COVID-19 – an update on current clinical trials. https://www.touchophthalmology.com/insight/treatments-for-covid-19-an-update-on-current-clinical-trials/. Accessed: May 12, 2020.
- Lythgoe MP, Middleton P. Ongoing clinical trials for the management of the COVID-19 pandemic. Trends Pharmacol Sci 2020. doi:10.1016/j.tips.2020.03.006. Accessed: May 12, 2020