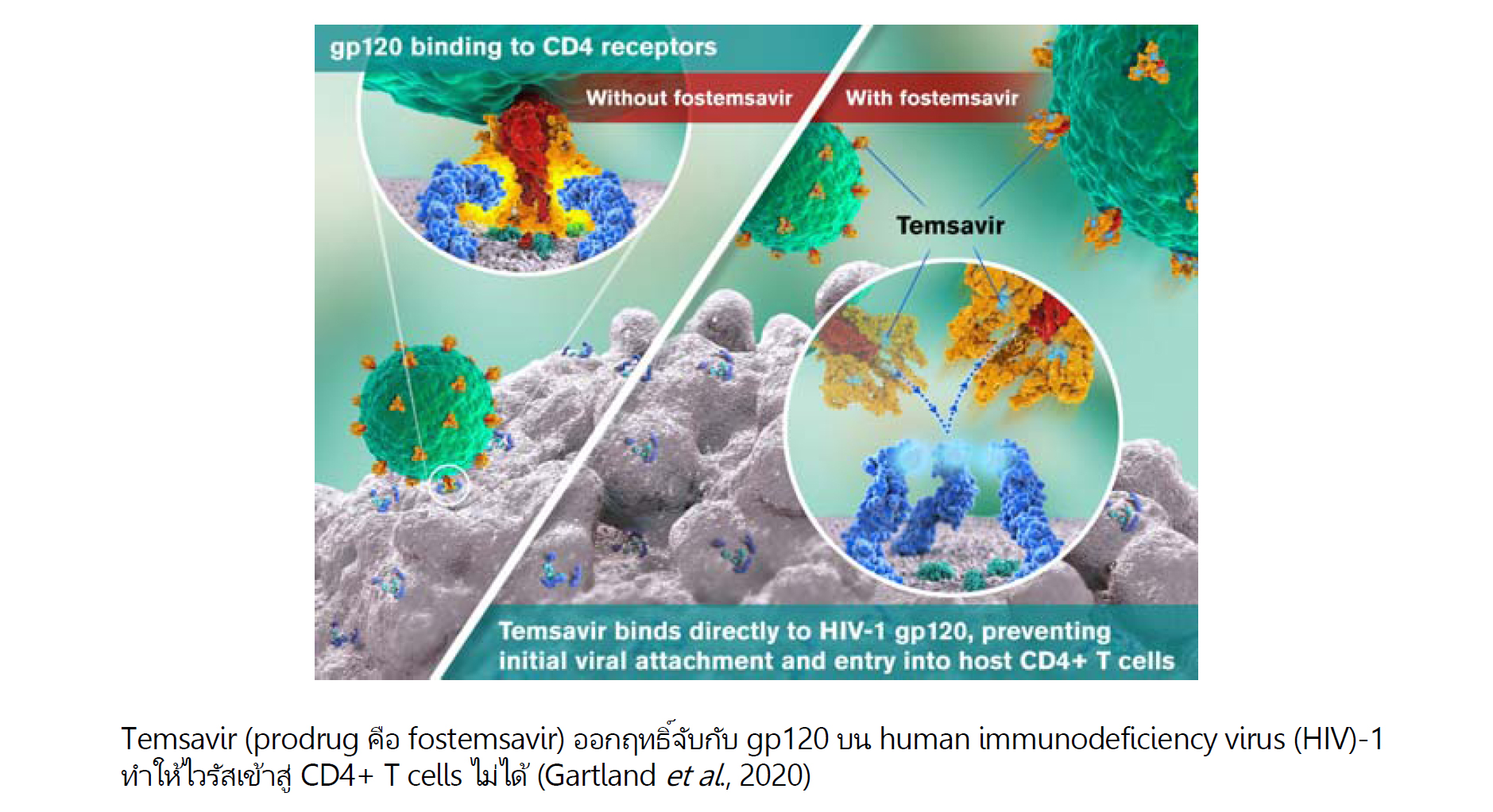
gp120 เป็น envelope glycoprotein หรือ surface protein ของ human immunodeficiency virus (HIV)-1 ซึ่งเป็นไวรัสก่อโรคเอดส์ (acquired immunodeficiency syndrome หรือ AIDS) ไวรัสชนิดนี้อาศัย gp120 ในการจับกับ CD4 บนเซลล์เป้าหมายเพื่อเข้าสู่ภายในเซลล์นั้น คือ CD4 positive T cell (CD4+ T cell, CD4 cell, T helper cell หรือ T4 cell ซึ่งมีบทบาทสำคัญมากในการทำงานของระบบภูมิคุ้มกัน) มีการศึกษาพบว่า temsavir ออกฤทธิ์จับกับ gp120 และทำให้ไวรัสเข้าสู่ CD4 cell ไม่ได้ (ดูรูป) และเมื่อเร็ว ๆ นี้ fostemsavir ซึ่งเป็น prodrug ของ temsavir ในรูป phosphonooxymethyl ester เพื่อเพิ่มการละลาย ได้รับอนุมัติให้วางจำหน่ายในบางประเทศในข้อบ่งใช้สำหรับผู้ใหญ่เพื่อรักษาโรคติดเชื้อเอชไอวีที่ดื้อต่อการรักษาหรือทนต่อการใช้ยาอื่นไม่ได้ โดยใช้ร่วมกับ antiretroviral ชนิดอื่น ผลิตออกจำหน่ายในรูปยาเม็ดชนิดทยอยปลดปล่อยตัวยา (extended-release tablet) เพื่อให้ออกฤทธิ์ได้นาน โดยมีตัวยา 600 มิลลิกรัม รับประทานครั้งละ 1 เม็ด วันละ 2 ครั้ง พร้อมอาหารหรือไม่ก็ได้
การที่ยานี้ได้รับอนุมัติในข้อบ่งใช้ข้างต้น เนื่องจากมีการศึกษาทางคลินิกระยะที่ 3 เป็นเวลานาน 96 สัปดาห์มาสนับสนุน การศึกษาเป็นแบบ partially-randomized, international, double-blind, placebo-controlled trial โดยศึกษาในผู้ใหญ่จำนวน 371 คนที่ติดเชื้อเอชไอวีที่ดื้อยาหลายชนิด มี viral load ไม่น้อยกว่า 400 copies/mL และได้ใช้ antiretrovirals มาแล้วไม่เกิน 2 กลุ่ม การศึกษามีทั้งแบบ randomized cohort และ nonrandomized cohort ในกรณีที่เป็น randomized cohort (n=272) ผู้ป่วยผ่านการใช้ยาที่ใช้ได้ผลมาแล้ว 1 หรือ 2 ชนิด แบ่งผู้ป่วยเป็น 2 กลุ่ม เพื่อให้ fostemsavir 600 มิลลิกรัม แบบปกปิดชื่อยา รับประทานวันละ 2 ครั้ง (n=203) หรือยาหลอก (n=69) โดยให้เพิ่มเติมจากยาเดิม (failing regimen) เป็นเวลา 8 วัน (monotherapy) ผลการศึกษาพบว่า fostemsavir ลดปริมาณไวรัสดีกว่ายาหลอก จากนั้นผู้ป่วยทั้ง 272 คน ได้รับ fostemsavir 600 มิลลิกรัม แบบเปิดเผยชื่อยา รับประทานวันละ 2 ครั้ง ร่วมกับยาที่เป็น optimized background therapy (OBT) 1 ชนิด ผลการศึกษาพบว่าผู้ป่วยที่มีปริมาณไวรัสเหลือ <200 copies/mL ในสัปดาห์ 24 มี 68% และในสัปดาห์ที่ 96 มี 64% ในขณะที่ CD4 cell เพิ่มขึ้นตามระยะเวลา ส่วนการศึกษาแบบ nonrandomized cohort (n=99) ผู้ป่วยส่วนใหญ่ (81%) ไม่มียาใดเลยที่ใช้ได้ผล มีเพียง 19% ที่เคยใช้ยาได้ผล 1 ชนิด ช่วงที่ทำการศึกษาไม่มีผู้ป่วยรายใดใช้ยาเดิม ผู้ป่วยเหล่านี้ได้รับ fostemsavir 600 มิลลิกรัม รับประทานวันละ 2 ครั้ง ร่วมกับ OBT ตั้งแต่วันแรก โดยอนุญาตให้ใช้ investigational agent เป็น OBT ได้ (มีผู้ป่วย 15 คน คิดเป็น 15% ได้รับ ibalizumab ซึ่งขณะนั้นยังเป็น investigational agent) ผลการศึกษาพบว่าผู้ป่วยที่มีปริมาณไวรัสเหลือ <200 copies/mL ในสัปดาห์ที่ 24 มี 42% และในสัปดาห์ที่ 96 มี 39% ในจำนวนนี้ผู้ที่มีปริมาณไวรัสเหลือ <40 copies/mL ในสัปดาห์ที่ 24 และสัปดาห์ที่ 96 มี 37% ในขณะที่ CD4 cell เพิ่มขึ้นตามระยะเวลา ส่วนอาการไม่พึงประสงค์ที่พบบ่อย (≥5%) ได้แก่ คลื่นไส้
อ้างอิงจาก:
(1) Gartland M, Ackerman P, Mannino F, Garside L, Clark A, Pierce A, et al. Clinical Significance of gp120 Polymorphisms, TMR IC50 FC, and HIV-1 Subtype in BRIGHTE, Poster 0503. Conference on Retroviruses and Opportunistic Infections; March 8-11, 2020; Boston, MA.
http://www.natap.org/2020/CROI/1430_1_Gartland_00503.pdf; (2) Rukobia (fostemsavir) extended-release tablets. Highlights of prescribing information. Reference ID: 4635448, revised: 07/2020.
https://www.accessdata.fda.gov/drugsatfda_docs/label/2020/212950s000lbl.pdf

