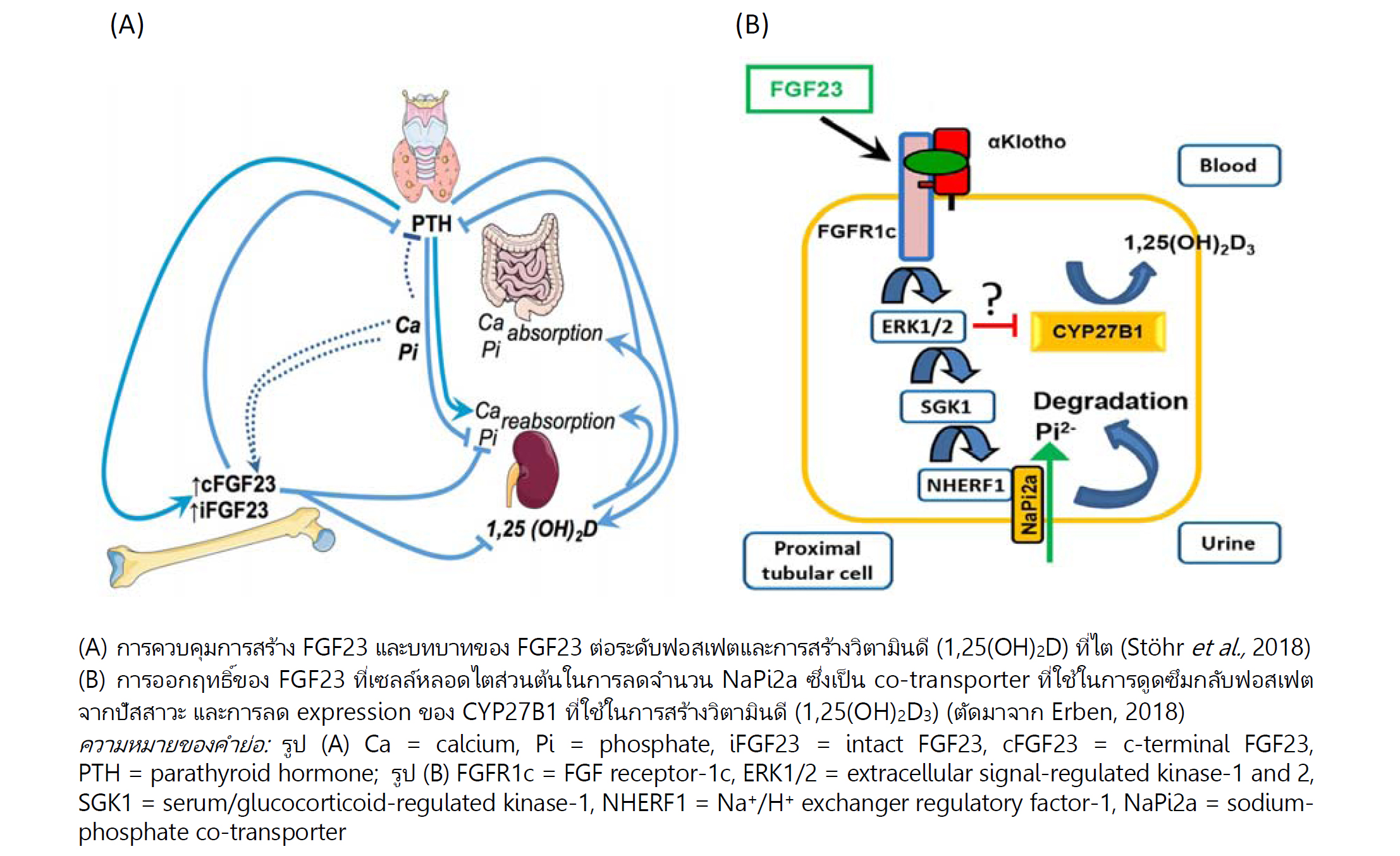
Fibroblast growth factors (FGFs) ช่วยกระตุ้นการเจริญของเซลล์ ในคนมีไม่น้อยกว่า 22 กลุ่ม ส่วนใหญ่ทำหน้าที่เป็น paracrine factors มีเพียงบางชนิดซึ่งรวมถึง FGF23 ที่ทำหน้าที่เป็น endocrine factors เหมือนฮอร์โมน ส่วนใหญ่ FGF23 ที่อยู่ในเลือดสร้างจากเซลล์กระดูก (osteocytes) มีการศึกษาที่แสดงให้เห็นว่า 1,25-dihydroxyvitamin D (ชื่ออื่น: 1,25-dihydroxycholecalciferol; 1alpha,25-dihydroxyvitamin D3; 1α,25(OH)2D3; 1,25(OH)2D; calcitriol ซึ่งเป็นวิตามินดีในรูปที่มีฤทธิ์) และพาราไทรอยด์ฮอร์โมน (PTH) กระตุ้นการสร้าง FGF23 และ FGF23 สามารถยับยั้งการหลั่ง PTH ได้ (ดูรูป A) อวัยวะเป้าหมายที่สำคัญของ FGF23 คือหลอดไต (renal tubules) การออกฤทธิ์ของ FGF23 ผ่านการจับกับตัวรับซึ่งที่ไตต้องอาศัย alpha-Klotho (αKlotho) เป็น co-receptor โดยปกติแล้วฟอสเฟตที่กรองผ่านกลอเมอรูลัสจะถูกดูดซึมกลับที่หลอดไตส่วนต้น (renal proximal tubules) แต่ FGF23 จะขัดขวางการดูดซึมกลับดังกล่าวโดยออกฤทธิ์ลดจำนวน sodium-phosphate co-transporter ทำให้มีการขับถ่ายฟอสเฟตทางปัสสาวะมากขึ้น (ดูรูป B) นอกจากนี้ FGF23 ยังยับยั้ง expression ของ 25-hydroxyvitamin D-1α-hydroxylase (CYP27B1) ซึ่งเป็นเอนไซม์ที่เปลี่ยน 25-hydroxyvitamin D ให้เป็น 1,25-dihydroxyvitamin D ซึ่งเป็นวิตามินดีชนิดที่มีฤทธิ์กระตุ้นการดูดซึมแคลเซียมและฟอสเฟตจากทางเดินอาหาร นอกจากนี้ FGF23 ยังเพิ่ม expression ของ 25-hydroxyvitamin D-24-hydroyxlase (CYP24A1) ซึ่งเป็นเอนไซม์ที่เปลี่ยน 25-hydroxyvitamin D และ 1,25-dihydroxyvitamin D ไปเป็นสารอื่น (จึงลดสารที่จะใช้สร้าง 1,25-dihydroxyvitamin D และยังเพิ่มการทำลาย 1,25-dihydroxyvitamin D อีกด้วย) ดังนั้น FGF23 ทำให้เกิดภาวะฟอสเฟตในเลือดต่ำโดยยับยั้งการดูดซึมกลับของฟอสเฟตที่หลอดไตส่วนต้นและลดการดูดซึมฟอสเฟตที่ทางเดินอาหาร จากข้อมูลที่มีอยู่พบว่า FGF23 มีระดับสูงขึ้นในผู้ที่เป็นโรคหรือมีความผิดปกติหลายชนิดที่สัมพันธ์กับภาวะฟอสเฟตในเลือดต่ำ รวมถึง X-linked hypophosphatemia
X-linked hypophosphatemia (XLH) เป็นภาวะฟอสเฟตในเลือดต่ำทางพันธุกรรมที่พบได้ยาก ผู้ป่วยมีการขับถ่ายฟอสเฟตออกทางปัสสาวะปริมาณมาก สาเหตุมาจากการกลายพันธุ์ของยีน PHEX (phosphate-regulating endopeptidase homolog X-linked gene) บน X chromosome พบ XLH ในผู้หญิงมากกว่าผู้ชาย (2:1) การกลายพันธุ์ของยีน PHEX ทำให้มีระดับ FGF23 ในพลาสมาสูงขึ้น จึงรบกวนการดูดซึมกลับของฟอสเฟตที่ไตและลดปริมาณวิตามินดีในรูปที่มีฤทธิ์ ภาวะฟอสเฟตในเลือดต่ำเรื้อรังเป็นสาเหตุสำคัญของโรคกระดูกอ่อนในเด็ก (rickets) และโรคกระดูกน่วม (osteomalacia) ในผู้ใหญ่ ซึ่งโรคกระดูกอ่อนในเด็กทำให้เด็กโตช้า กระดูกมีรูปร่างผิดปกติ ปวดกระดูก และฟันเจริญผิดปกติ ส่วนโรคกระดูกน่วมในผู้ใหญ่อาจพบกล้ามเนื้ออ่อนแรงขั้นรุนแรงและปวดกระดูก การมี FGF23 มากเกินไปยังทำให้เกิดโรคอื่นอีกหลายชนิดที่เกี่ยวข้องกับภาวะฟอสเฟตในเลือดต่ำ
การรักษาโรคที่เกี่ยวข้องกับภาวะฟอสเฟตในเลือดต่ำ ทำได้โดยให้เกลือฟอสเฟต (20-60 มิลลิกรัม/กิโลกรัม/วัน แบ่งให้) และวิตามินดีในรูปที่พร้อมออกฤทธิ์ (เช่น calcitriol ขนาด 20-30 นาโนกรัม/กิโลกรัม/วัน หรือ alfacalcidiol ขนาด 1-3 ไมโครกรัม/วัน แบ่งให้) โดยปรับขนาดยาให้เหมาะสมกับผู้ป่วยแต่ละรายโดยคำนึงถึงอาการไม่พึงประสงค์ด้วย (เช่น อาการในทางเดินอาหาร ภาวะแคลเซียมในเลือดสูง ภาวะแคลเซียมในปัสสาวะสูง ภาวะฟอสเฟตในเลือดสูง การรบกวนการทำงานของไต) ผู้ป่วย XLH หลายรายให้การตอบสนองไม่ดีหรือดื้อต่อการรักษาด้วยยาดังกล่าว จึงมีการคิดค้นยาอื่นรวมถึงยาที่ต้านฤทธิ์ FGF23 เช่น แอนติบอดีที่จับจำเพาะกับ FGF23 ซึ่งยาที่วางจำหน่ายแล้ว ได้แก่ burosumab หรือคิดค้นยาที่ขัดขวางขั้นตอนที่เกิดขึ้นหลังจาก FGF23 จับกับตัวรับแล้ว (signaling inhibitors) อย่างไรก็ตาม ต้องระวังด้วยว่าหากยับยั้งฤทธิ์ FGF23 มากเกินจนเกิดการขาด FGF23 อาจทำให้เกิดภาวะฟอสเฟตในเลือดสูงและเป็นโรคหลายอย่างตามมา นอกจากนี้ในผู้ป่วยโรคไตเรื้อรังร่างกายจะสร้าง FGF23 มากขึ้นเพื่อใช้ปรับสมดุลแร่ธาตุ แต่มักสร้างมากเกินความจำเป็น จึงคาดว่าผู้ป่วยโรคไตเรื้อรังอาจได้ประโยชน์จากการใช้ยาต้านฤทธิ์ FGF23 ดังกล่าวด้วย อย่างไรก็ตามยังไม่มีหลักฐานยืนยันถึงประโยชน์ของยาต้านฤทธิ์ FGF23 ในผู้ป่วยโรคไตเรื้อรัง
อ้างอิงจาก:
(1) Erben RG. Physiological actions of fibroblast growth factor-23. Front Endocrinol 2018. doi: 10.3389/fendo.2018.00267; (2) Stöhr R, Schuh A, Heine GH, Brandenburg V. FGF23 in cardiovascular disease: innocent bystander or active mediator? Front Endocrinol 2018. doi: 10.3389/fendo.2018.00351; (3) Imel EA, White KE. Pharmacologic management of X-linked hypophosphatemia. Br J Clin Pharmacol 2018. doi: 10.1111/bcp.13763; (4) Fukumoto S. Targeting fibroblast growth factor 23 signaling with antibodies and inhibitors, is there a rationale? Front Endocrinol 2018. doi: 10.3389/fendo.2018.00048.

