
|
รองศาสตราจารย์ ดร. เภสัชกรหญิง นงลักษณ์ สุขวาณิชย์ศิลป์ หน่วยคลังข้อมูลยา คณะเภสัชศาสตร์ มหาวิทยาลัยมหิดล |
|
| 41,229 ครั้ง เมื่อ 4 ช.ม.ที่แล้ว | |
| 2021-09-29 |
โควิด-19 (COVID-19) เป็นโรคติดเชื้อที่ทางเดินหายใจ เกิดจากโคโรนาไวรัสสายพันธุ์ใหม่ คือ “2019-nCoV (2019 novel coronavirus)” หรือ “SARS-CoV-2” เริ่มเกิดการระบาดที่เมืองอู่ฮั่นในประเทศจีน (Wuhan, China) เมื่อเดือนธันวาคมปี พ.ศ. 2562 (ค.ศ. 2019) ปัจจุบันยังคงมีการระบาดอย่างกว้างขวางในหลายประเทศทั่วโลกรวมถึงประเทศไทย มีผู้เสียชีวิตเป็นจำนวนมากเนื่องจากการหายใจล้มเหลวและอาการแทรกซ้อนอื่น การพัฒนาวัคซีนเพื่อป้องกันโรคนี้เริ่มมาตั้งแต่ไตรมาสแรกของปี พ.ศ. 2563 ขณะนี้ทั่วโลกมีวัคซีนโควิด-19 ออกใช้แล้วหลายผลิตภัณฑ์ ในขณะเดียวกันข้อมูลด้านผลไม่พึงประสงค์ของวัคซีนมีออกมาอย่างต่อเนื่องเช่นเดียวกัน จึงสร้างความกังวลให้กับผู้ที่ต้องการฉีดวัคซีน ในบทความนี้รวบรวมข้อมูลเกี่ยวกับผลไม่พึงประสงค์ของวัคซีนโควิด-19 จำนวน 4 ผลิตภัณฑ์ คือ วัคซีนไฟเซอร์ (Pfizer COVID-19 vaccine ที่มีชื่อการค้า Comirnaty), วัคซีนโมเดอร์นา (Moderna COVID-19 vaccine ที่มีชื่อการค้า Spikevax), วัคซีนแจนเซน (Janssen COVID-19 vaccine) และวัคซีนแอสทราเซเนกา (AstraZeneca COVID-19 vaccine ที่มีชื่อการค้า Vaxzevria) โดยกล่าวถึงชนิดของผลไม่พึงประสงค์ที่พบ อาการที่เกิดขึ้น อุบัติการณ์ และการเฝ้าระวังผลไม่พึงประสงค์ที่อาจเกิดขึ้นภายหลังได้รับการฉีดวัคซีน ซึ่งข้อมูลที่เกี่ยวข้องกับผลไม่พึงประสงค์ที่พบจากการใช้วัคซีนผลิตภัณฑ์ที่กล่าวข้างต้นอาจพบได้เมื่อใช้วัคซีนผลิตภัณฑ์อื่น ด้วยเหตุนี้การเฝ้าระวังผลไม่พึงประสงค์ภายหลังได้รับการฉีดวัคซีนจึงนำไปใช้ประโยชน์กับวัคซีนผลิตภัณฑ์อื่นได้ 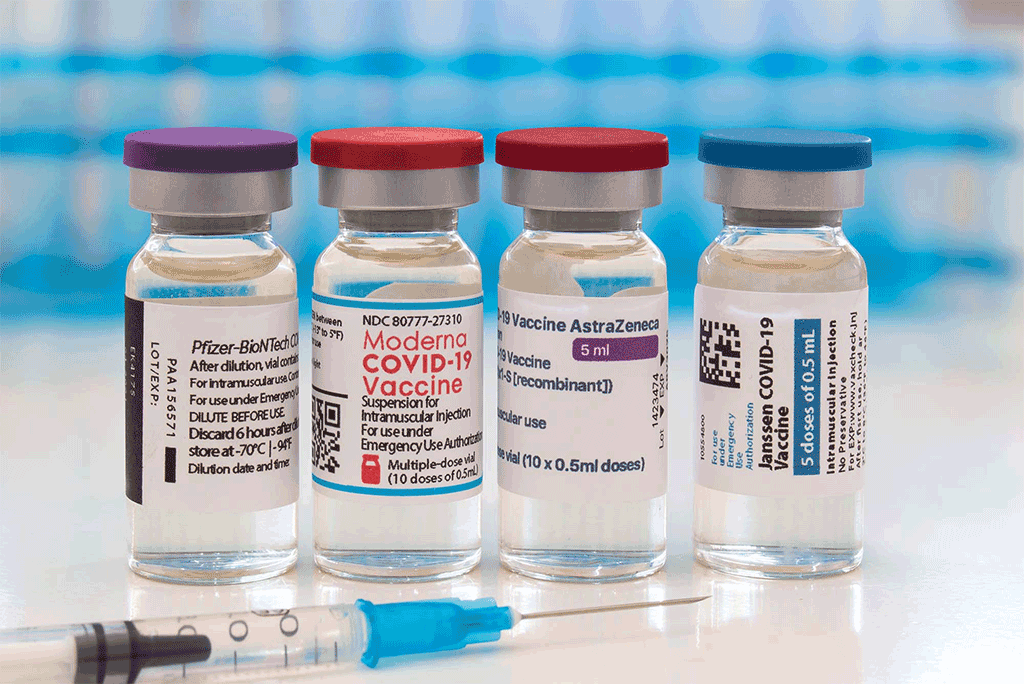
ภาพจาก : https://www.bu.edu/files/2021/08/feat-covid-vaccine-bottles-2F98YBD.jpg
“ผลข้างเคียง” “ผลไม่พึงประสงค์” และ“เหตุการณ์ไม่พึงประสงค์” หมายถึงอะไร?
เมื่อได้รับยา (รวมถึงวัคซีน) ผลของยาที่เกิดขึ้นมีทั้งผลที่ต้องการและผลที่ไม่ต้องการ ผลที่ต้องการหมายถึงผลที่นำไปใช้ประโยชน์ในการรักษาโรค ป้องกันโรค หรือวินิจฉัยโรค แล้วแต่กรณี ส่วนผลที่ไม่ต้องการมีคำที่ใช้กันเรียกหลายอย่าง ตัวอย่างได้แก่ ผลข้างเคียง ผลไม่พึงประสงค์ และเหตุการณ์ไม่พึงประสงค์ ผลที่ไม่ต้องการเหล่านี้เกิดขึ้นเมื่อใช้ยาในขนาดปกติ ซึ่ง “ผลข้างเคียง (side effect)” ของยา หมายถึงผลอื่นของยาซึ่งเกิดเคียงข้างไปกับผลที่ต้องการ บางอย่างอาจเกิดผลเสียต่อร่างกายแต่มักไม่เป็นอันตราย ส่วน “ผลไม่พึงประสงค์ (adverse effect)” ของยา หรืออาจเรียกว่าผลเสียของยา หมายถึงเป็นผลใด ๆ ของยาซึ่งไม่ใช่ผลที่ต้องการและทำให้เกิดผลเสียหรือเป็นอันตรายต่อร่างกาย จึงมีความหมายกว้างและครอบคลุมถึงผลข้างเคียงชนิดที่เกิดผลเสียต่อร่างกาย และ “เหตุการณ์ไม่พึงประสงค์ (adverse event)” หลังการใช้ยา หมายถึงเหตุการณ์หรือสิ่งผิดปกติใด ๆ ที่ทำให้เกิดผลเสียต่อร่างกายซึ่งเกิดขึ้นภายหลังการใช้ยา โดยเหตุการณ์หรือสิ่งผิดปกติที่เกิดขึ้นนั้นยังไม่ได้พิสูจน์แน่ชัดว่ามีสาเหตุมาจากยา คำเหล่านี้อาจครอบคลุมผลที่ไม่ต้องการที่เป็นสิ่งเดียวกัน จึงพบว่าบางครั้งมีการนำคำเหล่านี้มาใช้ในความหมายที่คาบเกี่ยวกัน ในบทความนี้ขอกล่าวถึงผลที่ไม่ต้องการทั้งหลายของวัคซีนโควิด-19 ไว้ภายใต้หัวข้อที่มีคำว่า “ผลไม่พึงประสงค์”
ที่มาของข้อมูลเกี่ยวกับผลไม่พึงประสงค์ของวัคซีนโควิด-19
ในประเทศต่าง ๆ จะมีการติดตามความปลอดภัยในการใช้วัคซีนโควิด-19 อย่างเป็นระบบ เช่น ประเทศสหรัฐอเมริกามีหน่วยงานที่รับรายงานเกี่ยวกับเหตุการณ์ไม่พึงประสงค์ของวัคซีนโควิด-19 ผ่าน Vaccine Adverse Event Reporting System หรือ VAERS ซึ่งบริหารจัดการโดยหน่วยงาน Centers for Disease Control and Prevention (CDC) และ Food and Drug Administration (FDA) ส่วนในสหภาพยุโรปหรืออียู (European Union หรือ EU) มีหน่วยงาน PRAC (Pharmacovigilance Risk Assessment Committee ซึ่งเป็นหน่วยงานของ European Medicines Agency หรือ EMA) รวบรวมผลไม่พึงประสงค์ของวัคซีนโควิด-19 ที่ใช้ในสหภาพยุโรปและครอบคลุมถึงกลุ่มประเทศในเขตเศรษฐกิจยุโรปหรืออีอีเอ (European Economic Area หรือ EEA) ข้อมูลเกี่ยวกับผลไม่พึงประสงค์ของวัคซีนโควิด-19 ในบทความนี้ส่วนใหญ่มาจากเอกสารที่เป็นข้อมูลผลิตภัณฑ์วัคซีนแต่ละชนิด (package insert หรือ product information) วารสารวิชาการ และเอกสารจากหน่วยงานที่ติดตามความปลอดภัยของวัคซีนโควิด-19 ในประเทศสหรัฐอเมริกาและสหภาพยุโรปตามที่กล่าวข้างต้น ทั้งนี้จะไม่รวมถึงข้อมูลจากแหล่งข่าวทั่วไป
วัคซีนโควิด-19 จำนวน 4 ผลิตภัณฑ์ที่กล่าวในบทความนี้มีทั้งแพลตฟอร์ม (platform ซึ่งหมายถึงโครงสร้างพื้นฐานของวัคซีนที่เกิดจากกรรมวิธีหรือเทคโนโลยีที่ใช้ผลิตวัคซีน) ชนิดที่เป็นเอ็มอาร์เอ็นเอ (messenger ribonucleic acid หรือ mRNA) ได้แก่ วัคซีนไฟเซอร์และวัคซีนโมเดอร์นา และชนิดที่มีอะดีโนไวรัสเป็นพาหะ (adenovirus vector) ได้แก่ วัคซีนแอสทราเซเนกาและวัคซีนแจนเซน (หรือวัคซีนจอห์นสันแอนด์จอห์นสัน) ข้อมูลที่มาจากประเทศสหรัฐอเมริกาเป็นของวัคซีนไฟเซอร์ วัคซีนโมเดอร์นาและวัคซีนแจนเซน โดยช่วงที่รวบรวมข้อมูลนี้วัคซีนไฟเซอร์ใช้กับผู้ที่มีอายุตั้งแต่ 12 ปีขึ้นไป ส่วนวัคซีนโมเดอร์นาและวัคซีนแจนเซนใช้ในผู้ที่มีอายุ 18 ปีขึ้นไป ส่วนข้อมูลที่มาจากสหภาพยุโรป (รวมถึงกลุ่มประเทศในเขตเศรษฐกิจยุโรปและสหราชอาณาจักร) เป็นของวัคซีนแอสทราเซเนกา วัคซีนไฟเซอร์ วัคซีนโมเดอร์นาและวัคซีนแจนเซน โดยวัคซีนไฟเซอร์และวัคซีนโมเดอร์นาใช้ในผู้ที่มีอายุตั้งแต่ 12 ปีขึ้นไป ส่วนวัคซีนแอสทราเซเนกาและวัคซีนแจนเซนใช้ในผู้ที่มีอายุ 18 ปีขึ้นไป วัคซีนต่าง ๆ ที่กล่าวถึงนั้นเป็นชนิดฉีด 2 เข็ม ยกเว้นวัคซีนแจนเซนที่ฉีดเพียงเข็มเดียว
ผลไม่พึงประสงค์ของวัคซีนโควิด-19
การใช้ยา (รวมถึงการฉีดวัคซีน) จะใช้ต่อเมื่อประโยชน์ที่ได้รับมีมากกว่าความเสี่ยงต่ออันตรายจากผลไม่พึงประสงค์ที่จะเกิดขึ้น โดวิด-19 เป็นโรคที่มีอัตราการเสียชีวิตสูง ด้วยเหตุนี้ในผู้ที่มีความเสี่ยงสูงที่จะติดเชื้อประโยชน์ที่ได้รับจากการฉีดวัคซีนจึงมีมากกว่าความเสี่ยงต่ออันตรายจากผลไม่พึงประสงค์ของวัคซีน ผลไม่พึงประสงค์ของวัคซีนโควิด-19 ที่จะกล่าวถึงจำแนกเป็นประเภทต่าง ๆ ดังนี้
1. ปฏิกิริยาเฉพาะที่ ผลจากปฏิกิริยาเฉพาะที่ซึ่งเกิดตรงบริเวณที่ฉีด เช่น ปวด บวม แดง คันและมีรอยช้ำ พบได้บ่อยภายหลังการฉีดวัคซีนไม่ว่าชนิดใด เกิดไม่รุนแรงและอาการจะค่อย ๆ ทุเลาได้เองภายในเวลาไม่นาน มีการศึกษาในประเทศเยอรมนีกับกลุ่มตัวอย่างซึ่งเป็นบุคลากรที่ทำงานเกี่ยวข้องกับผู้ป่วยจำนวน 599 คน ได้รับการฉีดวัคซีนไฟเซอร์ วัคซีนโมเดอร์นาและวัคซีนแอสทราเซเนกา ผลข้างเคียงที่พบมากที่สุด คือ ผลจากปฏิกิริยาเฉพาะที่ ได้แก่ ปวด 75.6%, บวม 18% และแดง 10.4% อาการเหล่านี้ทุเลาได้เองซึ่งส่วนใหญ่ใช้เวลา 1-3 วัน และการฉีดวัคซีนชนิดเอ็มอาร์เอ็นเอเกิดผลข้างเคียงดังกล่าวได้มากกว่าการฉีดวัคซีนชนิดที่มีอะดีโนไวรัสเป็นพาหะเล็กน้อย
2. อาการทั่วไปที่เกิดกับระบบทั่วร่างกาย อาการทั่วไปที่เกิดกับระบบทั่วร่างกายพบได้บ่อยภายหลังฉีดวัคซีน เช่น ร่างกายอ่อนล้า ปวดศีรษะ ปวดข้อ ปวดกล้ามเนื้อ มีไข้ หนาวสั่น คลื่นไส้ บางรายมีอาการอาเจียน เป็นลม ต่อมน้ำเหลืองโต ซึ่งอาการส่วนใหญ่เกิดจากปฏิกิริยาการตอบสนองทางภูมิค้มกัน (immune response) ของร่างกายที่มีต่อวัคซีน เกิดได้ไม่ว่าจะฉีดวัคซีนชนิดใด อาการบางอย่างอาจคงอยู่หลายวัน ส่วนใหญ่จะค่อย ๆ ทุเลาได้เอง สำหรับอาการปวดศีรษะ เป็นไข้ และปวดกล้ามเนื้อสามารถรับประทานยาพาราเซตามอลเพื่อช่วยบรรเทาอาการได้ มีการศึกษาในประเทศเยอรมนี (ตามที่กล่าวข้างต้น) พบผลข้างเคียงที่เกิดกับระบบทั่วร่างกาย ได้แก่ ปวดศีรษะ/อ่อนล้า 53.6%, ปวดกล้ามเนื้อ 33.2%, ไม่สบายกาย 25%, หนาวสั่น 23% และปวดข้อ 21.2% อาการเหล่านี้ทุเลาได้เองซึ่งส่วนใหญ่ใช้เวลา 1-3 วัน และการฉีดวัคซีนชนิดที่มีอะดีโนไวรัสเป็นพาหะเกิดผลข้างเคียงดังกล่าวได้มากกว่าการฉีดวัคซีนชนิดเอ็มอาร์เอ็นเอ
3. การแพ้ยา การแพ้ยา (allergic reaction) เป็นปฏิกิริยาภูมิไวเกินที่เกิดเนื่องจากระบบภูมิคุ้มกันให้การตอบสนองต่อสารกระตุ้นภูมิคุ้มกัน (หรือสารก่อภูมิแพ้) ที่เคยได้รับมาก่อน ทำให้เกิดการหลั่งสารสื่อบางชนิดส่งผลให้ร่างกายแสดงอาการต่าง ๆ เช่น ผื่นขึ้น ลมพิษ ริมฝีปากบวม ขอบตาบวม เยื่อเมือกทางเดินหายใจบวม หลอดลมหดตัว หายใจลำบาก ความดันโลหิตต่ำ หากการแพ้เป็นชนิด “แอนาฟิแล็กซิส (anaphylaxis)” ซึ่งเกิดแบบเฉียบพลันและรุนแรง อาจเสียชีวิตได้ ต้องให้การรักษาโดยเร็วด้วยอะดรีนาลีน (adrenaline) หรือชื่ออื่นคืออีพิเนฟริน (epinephrine) ฉีดเข้ากล้ามเนื้อ ซึ่งสถานที่ฉีดวัคซีนจะมียาเตรียมพร้อมไว้ มีข้อมูลจากการฉีดวัคซีนไฟเซอร์เข็มแรกพบว่าการแพ้แบบแอนาฟิแล็กซิสเกิดขึ้นเร็วโดยมีค่ากลาง (median) อยู่ที่ 13 นาทีหลังจากฉีดวัคซีน (ช่วงเวลาที่เกิด 2-150 นาที) วัคซีนโควิด-19 ทั้งหลายล้วนมีโอกาสทำให้เกิดการแพ้แบบแอนาฟิแล็กซิสได้แต่พบน้อย และหากเกิดขึ้นภายหลังฉีดเข็มแรกจะไม่ฉีดวัคซีนชนิดเดิมในเข็มที่สอง ในประเทศสหรัฐอเมริกามีการประมาณถึงการแพ้วัคซีนแบบแอนาฟิแล็กซิสว่าพบได้ราว 2-5 คนในผู้ที่ฉีด 1 ล้านคน
วัคซีนชนิดนี้เอ็มอาร์เอ็นเอมีส่วนผสมของสารโพลีเอทิลีนไกลคอลหรือพีอีจี (polyethylene glycol หรือ PEG) ซึ่งใช้เคลือบโมเลกุลของเอ็มอาร์เอ็นเอเพื่อพาเข้าสู่ภายในเซลล์ร่างกาย สารนี้มีใช้ทางด้านยา เครื่องสำอาง และอาหาร แต่เป็นสารใหม่ที่ใช้กับวัคซีน ผู้ที่แพ้สารพีอีจีแบบแอนาฟิแล็กซิสจึงห้ามฉีดวัคซีนชนิดเอ็มอาร์เอ็นเอ ทำนองเดียวกันกับวัคซีนชนิดที่มีอะดีโนไวรัสเป็นพาหะจะมีสารโพลีซอร์เบต 80 (polysorbate 80 หรือที่บางคนคุ้นเคยกับชื่อการค้าว่า Tween 80) ผสมอยู่ สารนี้มีใช้ทางด้านยา เครื่องสำอาง และอาหาร มีใช้บ้างกับวัคซีน ผู้ที่แพ้สารโพลีซอร์เบต 80 แบบแอนาฟิแล็กซิสจึงห้ามฉีดวัคซีนชนิดที่มีอะดีโนไวรัสเป็นพาหะ นอกจากนี้สารพีอีจีและสารโพลีซอร์เบต 80 มีโครงสร้างบางส่วนที่คล้ายกัน ดังนั้นผู้ที่แพ้สารพีอีจีควรระมัดระวังว่าอาจแพ้สารโพลีซอร์เบต 80 และทำนองเดียวกันผู้ที่แพ้สารโพลีซอร์เบต 80 ควรระมัดระวังว่าอาจแพ้สารพีอีจีด้วย ด้วยเหตุนี้ผู้ที่เข้ารับการฉีดวัคซีนหากมีประวัติว่าแพ้สารชนิดดังกล่าว ตลอดจนการแพ้ยาหรือแพ้สารใด ๆ ควรแจ้งบุคลากรทางการแพทย์ที่เป็นผู้ฉีดด้วย เนื่องจากผู้ที่มีประวัติเกี่ยวกับการแพ้ยาหรือแพ้สารใด ๆ จะมีความเสี่ยงต่อการแพ้วัคซีนได้มากกว่าผู้อื่นด้วย
4. ภาวะลิ่มเลือดอุดหลอดเลือดร่วมกับมีเกล็ดเลือดต่ำ ภาวะลิ่มเลือดอุดหลอดเลือดร่วมกับมีเกล็ดเลือดต่ำ (thrombosis with thrombocytopenia syndrome) เกิดจากปฏิกิริยาการตอบสนองทางภูมิคุ้มกันหลังได้รับวัคซีน (รู้จักกันในอีกชื่อหนึ่งว่า vaccine-induced immune thrombotic thrombocytopenia) เกิดได้น้อยแต่อาจเป็นอันตรายถึงชีวิต พบภายหลังได้รับวัคซีนแอสทราเซเนกาและวัคซีนแจนเซน ส่วนใหญ่เกิดภายใน 3 สัปดาห์หลังการฉีด ภาวะลิ่มเลือดอุดหลอดเลือดเกิดได้ทั้งหลอดเลือดแดงและหลอดเลือดดำ แต่มักพบที่หลอดเลือดดำในสมองและหลอดเลือดดำในช่องท้อง โดยพบร่วมกับเกล็ดเลือดต่ำและบางครั้งมีภาวะเลือดออกร่วมด้วย อาการเกิดได้หลากหลายขึ้นกับว่ามีลิ่มเลือดไปอุดตันในหลอดเลือดที่อวัยวะใด เช่น ที่ปอด ทำให้เกิดอาการเจ็บหน้าอก หายใจไม่สะดวก เหนื่อย, ที่หัวใจ ทำให้กล้ามเนื้อหัวใจขาดเลือด มีอาการปวดเค้นอก หัวใจเต้นผิดจังหวะ, ที่สมอง ทำให้มีอาการปวดศีรษะรุนแรง ชัก สับสน ตาพร่า ร่างกายชาครึ่งซีก แขนและขาอ่อนแรง, ที่ช่องท้อง ทำให้ปวดท้องมากและไม่หาย, ที่ขา ทำให้ขาบวม แดง และปวดขาข้างที่เกิดหลอดเลือดอุดตัน เป็นต้น นอกจากนี้อาจมีจุดเลือดออกใต้ผิวหนังซึ่งไม่ใช่ตรงบริเวณที่ฉีดวัคซีนและเกิดขึ้น 2-3 วันภายหลังฉีดวัคซีน หากเกิดความผิดปกติดังกล่าวข้างต้น (รวมถึงความผิดปกติอื่น ๆ ที่เป็นรุนแรง) ให้รีบไปโรงพยาบาลเพื่อรับการวินิจฉัยและการรักษาโดยเร็ว
ข้อมูลในประเทศสหรัฐอเมริกาพบภาวะลิ่มเลือดอุดหลอดเลือดร่วมกับมีเกล็ดเลือดต่ำภายหลังได้รับวัคซีนแจนเซนได้ประมาณ 1 ราย ต่อ 315,000 โดส (โดส หมายถึงปริมาณวัคซีนที่ได้รับแต่ละครั้ง ซึ่ง 1 คนจะได้รับ 1 โดส) พบในผู้หญิงอายุน้อยกว่า 50 ปี (บางแหล่งข้อมูลระบุไว้ที่น้อยกว่า 60 ปี) ได้มากกว่าผู้ได้รับวัคซีนกลุ่มอื่น (ข้อมูลจากหน่วยงาน PRAC ในระยะหลังพบความแตกต่างลดลงทั้งเรื่องอายุและเพศของผู้ที่เกิดภาวะดังกล่าวภายหลังได้รับวัคซีนแอสทราเซเนกา) การเกิดภาวะลิ่มเลือดอุดหลอดเลือดร่วมกับมีเกล็ดเลือดต่ำพบในผู้ที่ได้รับวัคซีนชนิดเอ็มอาร์เอ็นเอได้น้อยมากจนอาจถือว่าไม่ได้เพิ่มความเสี่ยงต่อภาวะดังกล่าว โดยพบเพียง 2 ราย (จากการฉีดวัคซีนโมเดอร์นา) ต่อการฉีดวัคซีนชนิดเอ็มอาร์เอ็นเอ 362 ล้านโดส ส่วนข้อมูลจากสหภาพยุโรปพบว่าการเกิดภาวะลิ่มเลือดอุดหลอดเลือดร่วมกับมีเกล็ดเลือดต่ำทั่วโลกพบ 1,503 ราย ต่อการฉีดวัคซีนแอสทราเซเนกา 592 ล้านโดส (1 ต่อ 4 แสนโดส) กรณีที่เกิดภาวะลิ่มเลือดอุดหลอดเลือดร่วมกับมีเกล็ดเลือดต่ำในสหภาพยุโรป (รวมถึงกลุ่มประเทศในเขตเศรษฐกิจยุโรปและสหราชอาณาจักร) ข้อมูลจากผู้ที่ได้รับการฉีดวัคซีนแอสทราเซเนกาประมาณ 25 ล้านคนพบลิ่มเลือดอุดตันที่หลอดเลือดดำในสมอง (cerebral venous sinus thrombosis) 62 ราย (1 ต่อ 4 แสนคน) และลิ่มเลือดอุดตันที่หลอดเลือดดำในช่องท้อง (splanchnic vein thrombosis) 24 ราย (1 ต่อ 1 ล้านคน) ในจำนวนนี้มีผู้เสียชีวิต 18 ราย
5. กล้ามเนื้อหัวใจอักเสบและเยื่อหุ้มหัวใจอักเสบ ผลไม่พึงประสงค์ของวัคซีนที่เกี่ยวกับกล้ามเนื้อหัวใจอักเสบ (myocarditis) และเยื่อหุ้มหัวใจอักเสบ (pericarditis) พบได้น้อย ความผิดปกติเหล่านี้เกิดจากปฏิกิริยาการตอบสนองของระบบภูมิคุ้มกันเช่นเดียวกัน พบภายหลังได้รับวัคซีนเข็มที่สองได้มากกว่าเข็มแรกและส่วนใหญ่เกิดภายใน 14 วันหลังจากฉีดวัคซีน ทำให้มีอาการเจ็บหน้าอก หายใจถี่ ใจสั่น หรือหัวใจเต้นผิดจังหวะ ส่วนใหญ่อาการไม่รุนแรงเมื่อเทียบกับกล้ามเนื้อหัวใจอักเสบที่เกิดจากสาเหตุอื่นรวมถึงสาเหตุที่มาจากการติดเชื้อไวรัส และส่วนใหญ่มีอาการดีขึ้นได้เองหรือภายหลังได้รับการรักษา แต่บางรายอาจมีอาการรุนแรงจนต้องเข้ารักษาตัวในโรงพยาบาล พบความผิดปกติดังกล่าวภายหลังการฉีดวัคซีนชนิดเอ็มอาร์เอ็นเอทั้งวัคซีนไฟเซอร์และวัคซีนโมเดอร์นา โดยพบในวัยรุ่นและผู้ที่มีอายุไม่เกิน 30 ปี (บางแหล่งข้อมูลระบุไว้ที่ไม่เกิน 40 ปี) ได้บ่อยกว่าคนที่มีอายุมาก และพบในผู้ชายมากกว่าผู้หญิง ข้อมูลจากประเทศสหรัฐอเมริกาพบ 854 รายจากการฉีดวัคซีนทั้งหมดมากกว่า 380 ล้านโดส (1 ต่อ 4.5 แสนโดส) ส่วนข้อมูลในสหภาพยุโรปรวมถึงกลุ่มประเทศในเขตเศรษฐกิจยุโรปพบกล้ามเนื้อหัวใจอักเสบ 19 รายจากการฉีดวัคซีนโมเดอร์นา 20 ล้านโดส (1 ต่อ 1 ล้านโดส) และพบเยื่อหุ้มหัวใจอักเสบ 138 รายจากการฉีดวัคซีนไฟเซอร์ 177 ล้านโดส (1 ต่อ 1.3 ล้านโดส)
6. กลุ่มอาการกิลแลง-บาร์เร กลุ่มอาการกิลแลง-บาร์เร (Guillain-Barré syndrome) เป็นความผิดปกติที่พบได้ยาก เกิดจากปฏิกิริยาการตอบสนองของระบบภูมิคุ้มกันในร่างกายที่ไปทำอันตรายต่อเซลล์ประสาท ทำให้กล้ามเนื้ออ่อนแรง อาจถึงขั้นเคลื่อนไหวไม่ได้หรือเป็นอัมพาต ส่วนใหญ่หายเป็นปกติได้ แต่มีบางรายที่เส้นประสาทได้รับความเสียหายอย่างถาวร วัคซีนบางผลิตภัณฑ์มีคำเตือนถึงความเสี่ยงต่อการเกิดกลุ่มอาการดังกล่าวได้ในช่วง 42 วันภายหลังการฉีดวัคซีน ในประเทศสหรัฐอเมริกาพบ 201 รายจากการฉีดวัคซีนแจนเซนกว่า 14.7 ล้านโดส (1 ต่อ 7.3 หมื่นโดส) โดยส่วนใหญ่พบในผู้ชายซึ่งหลายคนมีอายุตั้งแต่ 50 ปีขึ้นไป และส่วนใหญ่เกิดอาการประมาณ 2 สัปดาห์ภายหลังการฉีด ในสหภาพยุโรปได้รวบรวมข้อมูลเกี่ยวกับการเกิดกลุ่มอาการกิลแลง-บาร์เรจากทั่วโลกพบได้ 833 รายจากการฉีดวัคซีนแอสทราเซเนกา 592 ล้านโดส (1 ต่อ 7.1 แสนโดส)
7. กลุ่มอาการอักเสบของอวัยวะหลายระบบ กลุ่มอาการอักเสบของอวัยวะหลายระบบ (multisystem inflammatory syndrome) เป็นภาวะที่อันตราย ผู้ป่วยจะรู้สึกเหนื่อย ไข้สูงมากและไม่ลด ปวดศีรษะ ท้องเดิน อาเจียน ปวดท้อง เจ็บหน้าอกและหายใจลำบาก อาจพบได้ในผู้ที่ติดเชื้อโควิด-19 โดยพบในเด็กและวัยรุ่นได้มากกว่าผู้ใหญ่ มีรายงานว่าในประเทศเดนมาร์กวัยรุ่นผู้ชายอายุ 17 ปีเกิดกลุ่มอาการอักเสบของอวัยวะหลายระบบภายหลังฉีดวัคซีนไฟเซอร์โดยที่เด็กรายนี้ไม่เคยติดเชื้อโควิด-19มาก่อน อาการอักเสบต่าง ๆ หายไปภายหลังได้รับการรักษา นอกจากนี้ข้อมูลจากสหภาพยุโรป (รวมถึงกลุ่มประเทศในเขตเศรษฐกิจยุโรป) ยังพบกลุ่มอาการดังกล่าวทั้งในเด็กและผู้ใหญ่ภายหลังฉีดวัคซีนไฟเซอร์ 5 ราย, วัคซีนโมเดอร์นา 1 รายและวัคซีนแจนเซน 1 ราย (ยังไม่พบในผู้ที่ฉีดวัคซีนแอสทราเซเนกา ตามข้อมูลจาก EudraVigilance database วันที่ 19 สิงหาคม พ.ศ. 2564) ขณะนี้หน่วยงาน PRAC อยู่ระหว่างการศึกษาถึงความเป็นไปได้ว่าจะเกิดจากวัคซีนหรือไม่
8. กลุ่มอาการเส้นเลือดฝอยรั่ว กลุ่มอาการเส้นเลือดฝอยรั่ว (capillary leak syndrome) เป็นภาวะที่มีของเหลวและโปรตีนรั่วออกจากเส้นเลือดฝอยและไหลเข้าสู่เนื้อเยื่อโดยรอบ ทำให้เกิดอาการบวมน้ำเฉียบพลันซึ่งส่วนใหญ่เกิดที่แขนหรือขา ความดันโลหิตต่ำ เลือดข้น และอัลบูมินในเลือดลดลง กลุ่มอาการเส้นเลือดฝอยรั่วพบได้น้อยแต่เป็นอันตรายมาก ต้องได้รับการรักษาอย่างเร่งด่วน อาการเกิดขึ้นเร็วภายหลังได้รับวัคซีน มีรายงานถึงการเกิดกลุ่มอาการเส้นเลือดฝอยรั่วในวันแรกที่ฉีดวัคซีนแอสทราเซเนกาและวัคซีนแจนเซน บางรายมีประวัติของความผิดปกติดังกล่าวอยู่แล้ว และมีบางรายเสียชีวิต ด้วยเหตุนี้จึงห้ามฉีดวัคซีนแอสทราเซเนกาและวัคซีนแจนเซนในผู้ที่มีประวัติว่าเคยเกิดกลุ่มอาการเส้นเลือดฝอยรั่ว
9. การเสียชีวิตจากวัคซีน การเสียชีวิตจากวัคซีนเกิดขึ้นได้น้อย รายงานเกี่ยวกับการเสียชีวิตภายหลังการฉีดวัคซีนเป็นการรายงานเบื้องต้นโดยยังไม่ได้พิสูจน์ถึงสาเหตุที่แน่ชัด ซึ่งการพิสูจน์จะใช้เวลานาน ในประเทศสหรัฐอเมริกามีรายงานผู้เสียชีวิตภายหลังการฉีดวัคซีน 7,653 รายจากจำนวนวัคซีนที่ฉีด 380 ล้านโดส (1 ต่อ 5 หมื่นโดส) ซึ่งก่อนหน้านี้ในช่วงที่ฉีดได้ 339 ล้านโดส มีผู้เสียชีวิตที่ได้รับการพิสูจน์ว่าเกิดจากวัคซีนเพียง 3 ราย ส่วนในสหภาพยุโรป (รวมถึงกลุ่มประเทศในเขตเศรษฐกิจยุโรป) ในเบื้องต้นพบการเสียชีวิตภายหลังฉีดวัคซีนไฟเซอร์ 4,714 รายจากจำนวนที่ฉีด 392 ล้านโดส (1 ต่อ 8.3 หมื่นโดส), เสียชีวิตภายหลังฉีดวัคซีนโมเดอร์นา 447 รายจากจำนวนที่ฉีด 54.2 ล้านโดส (1 ต่อ 1.2 แสนโดส), เสียชีวิตภายหลังฉีดวัคซีนแจนเซน 138 รายจากจำนวนที่ฉีด 13.8 ล้านโดส (1 ต่อ 1 แสนโดส) และเสียชีวิตภายหลังฉีดวัคซีนแอสทราเซเนกา 1,149 รายจากจำนวนที่ฉีดกว่า 68.4 ล้านโดส (1 ต่อ 6 หมื่นโดส) คาดว่าการเสียชีวิตภายหลังการฉีดวัคซีนชนิดเอ็มอาร์เอนเอส่วนหนึ่งอาจมาจากกล้ามเนื้อหัวใจอักเสบ และการเสียชีวิตภายหลังการฉีดวัคซีนชนิดที่มีอะดีโนไวรัสเป็นพาหะส่วนหนึ่งอาจมาจากภาวะลิ่มเลือดอุดหลอดเลือดร่วมกับมีเกล็ดเลือดต่ำ ซึ่งผู้เสียชีวิตเหล่านี้จะได้รับการพิสูจน์หาสาเหตุที่แน่ชัด
10. ผลระยะยาว ขณะนี้คาดว่าวัคซีนไม่น่าจะส่งผลกระทบในระยะยาว ผลไม่พึงประสงค์มักพบในเวลาไม่เกิน 6 สัปดาห์หลังจากฉีดวัคซีน ในบางประเทศมีมาตรการติดตามความปลอดภัยของวัคซีนเป็นเวลา 8 สัปดาห์หรือ 2 เดือนภายหลังการฉีดครั้งสุดท้ายโดยทำงานร่วมกับเจ้าของผลิตภัณฑ์ หากมีความผิดปกติประการใดเกิดขึ้นสามารถตรวจสอบผลิตภัณฑ์วัคซีนรุ่นที่ผลิตได้ทันที
การเฝ้าระวังผลไม่พึงประสงค์ภายหลังการฉีดวัคซีนโควิด-19
1. การแพ้วัคซีนแบบแอนาฟิแล็กซิส ซึ่งเกิดแบบเฉียบพลันและรุนแรง เกิดขึ้นได้ไม่ว่าจะได้รับการฉีดเข็มแรกหรือเข็มที่สอง ประเทศต่าง ๆ จึงมีข้อแนะนำให้รอสังเกตอาการหลังฉีดไม่น้อยกว่า 15 นาที (หรือ 30 นาทีในคนที่มีประวัติว่าเคยเกิดอาการแพ้ยาหรือสารอื่นรุนแรง) อย่างไรก็ตามแม้พ้นช่วงเวลาดังกล่าวแล้วกว่า 2 ชั่วโมงยังอาจเกิดการแพ้แบบแอนาฟิแล็กซิสได้แม้จะพบน้อย ด้วยเหตุนี้แม้กลับถึงบ้านแล้วยังต้องสังเกตอาการ เช่น ผื่นขึ้น ลมพิษ ริมฝีปากบวม ขอบตาบวม หายใจลำบาก หากเกิดอาการดังกล่าวให้รีบไปโรงพยาบาลเพื่อรับการวินิจฉัยและการรักษาโดยเร็ว
2. อาการจากความวิตกกังวลหรือความกลัวการฉีดยา อาจมีอาการตั้งแต่ก่อนฉีดวัคซีน ภายหลังฉีดแล้วอาจเป็นลม หายใจแรง เวียนศีรษะ ใจสั่น ความดันโลหิตเปลี่ยนแปลง หรือเหงื่อออกมาก อาการเหล่านี้แม้ไม่ใช่ผลไม่พึงประสงค์ของวัคซีน แต่ควรเฝ้าระวังเพื่อไม่ให้เกิดอันตรายจากการเป็นลม อาการเหล่านี้เกิดเพียงชั่วคราวและทุเลาได้ในช่วงที่รอสังเกตอาการภายหลังฉีดวัคซีน
3. ภายหลังกลับบ้านแล้ว หากมีอาการเหล่านี้อย่างใดอย่างหนึ่งเกิดขึ้น เช่น ไข้สูงมากและไข้ไม่ลดแม้รับประทานยาลดไข้ ปวดศีรษะรุนแรง ความดันโลหิตต่ำ หน้ามืด ท้องเดิน อาเจียน ปวดท้องมากและไม่หาย เจ็บหน้าอก หายใจลำบาก หัวใจเต้นผิดจังหวะ ชัก สับสน ตาพร่า ร่างกายชาครึ่งซีก แขนและขาอ่อนแรง ขาบวม หรืออาการผิดปกติอื่น ๆ ที่เกิดรุนแรง ให้รีบไปโรงพยาบาลเพื่อรับการวินิจฉัยและการรักษาโดยเร็ว ซึ่งอาการที่กล่าวนี้อาจเกิดขึ้นเร็วตั้งแต่วันแรกที่ได้รับวัคซีนหรือเกิดหลังจากนั้นนานเป็นเดือน (ความผิดปกติบางอย่าง เช่น กลุ่มอาการกิลแลง-บาร์เรเกิดในช่วง 42 วันภายหลังการฉีดวัคซีน) อย่างไรก็ตามความผิดปกติส่วนใหญ่พบในช่วงไม่เกิน 3 สัปดาห์หลังจากฉีดวัคซีน
4. ผลไม่พึงประสงค์ของวัคซีนไม่ได้จำกัดเฉพาะแค่ที่มีรายงานเท่านั้น ยังอาจมีความผิดปกติอื่น ๆ เกิดขึ้นได้ จึงควรติดตามเฝ้าสังเกตอาการผิดปกติต่าง ๆ เป็นเวลาประมาณ 2 เดือนหลังจากฉีดวัคซีนเข็มสุดท้าย
คำเตือนและข้อแนะนำอื่น ๆ เกี่ยวกับการฉีดวัคซีนโควิด-19
1. ก่อนเข้ารับการฉีดวัคซีน หากมีไข้สูงเฉียบพลันหรือเกิดการติดเชื้อรุนแรงควรเลื่อนการฉีดวัคซีนไปก่อน แต่หากการติดเชื้อเกิดเพียงเล็กน้อยหรือมีไข้ต่ำ ๆ สามารถรับการฉีดวัคซีนได้
2. ผู้เข้ารับการฉีดวัคซีนหากมีประวัติว่าแพ้ยาหรือสารชนิดใดให้แจ้งบุคลากรทางการแพทย์ที่เป็นผู้ฉีดด้วย ซึ่งผู้ที่แพ้ส่วนประกอบใด ๆ ในวัคซีน (เกิดแอนาฟิแล็กซิส) จะห้ามฉีดวัคซีนนั้น ส่วนผู้ที่เกิดการแพ้ภายหลังฉีดเข็มแรกไม่ให้ฉีดวัคซีนชนิดนั้นในเข็มที่สอง แต่ถ้าเป็นการแพ้แบบอื่นที่ไม่ใช่แอนาฟิแล็กซิสอาจพิจารณาฉีดวัคซีนชนิดเดิมได้แต่ให้เฝ้าระวังอาการผิดปกติที่อาจเกิดขึ้นด้วย
3. ยังไม่มีหลักฐานว่าเมื่อเกิดการแพ้วัคซีนชนิดหนึ่งแล้วจะแพ้วัคซีนชนิดอื่นหรือไม่ แต่ถ้ารู้แน่ชัดว่าแพ้สารชนิดใดจะห้ามฉีดวัคซีนทุกชนิดที่มีสารชนิดนั้นผสมอยู่ อีกทั้งควรหลีกเลี่ยงการฉีดวัคซีนที่มีส่วนผสมของสารอื่นที่มีโครงสร้างคล้ายกันกับสารที่ผู้นั้นแพ้ (ดังรายละเอียดข้างต้นที่กล่าวถึงการแพ้สารพีอีจีและสารโพลีซอร์เบต 80 กล่าวคือ ผู้ที่แพ้สารพีอีจีจะห้ามฉีดวัคซีนชนิดเอ็มอาร์เอ็นเอและควรหลีกเลี่ยงการฉีดวัคซีนชนิดที่มีอะดีโนไวรัสเป็นพาหะ ทำนองเดียวกันผู้ที่สารโพลีซอร์เบต 80 จะห้ามฉีดวัคซีนชนิดที่มีอะดีโนไวรัสเป็นพาหะและควรหลีกเลี่ยงการฉีดวัคซีนชนิดเอ็มอาร์เอ็นเอ เนื่องจากสารพีอีจีและสารโพลีซอร์เบต 80 มีโครงสร้างบางส่วนที่คล้ายกัน)
4. ผู้ที่มีประวัติว่าเคยเกิดภาวะลิ่มเลือดอุดหลอดเลือดร่วมกับมีเกล็ดเลือดต่ำภายหลังการฉีดวัคซีนแอสทราเซเนกา ให้แจ้งบุคลากรทางการแพทย์ที่เป็นผู้ฉีดให้ทราบด้วย เนื่องจากบุคคลเหล่านี้จะห้ามฉีดวัคซีนแอสทราเซเนกาอีก (ตามข้อความในเอกสารที่เป็นข้อมูลผลิตภัณฑ์)
5. ผู้ที่มีประวัติว่าเคยเกิดกลุ่มอาการเส้นเลือดฝอยรั่ว ให้แจ้งบุคลากรทางการแพทย์ที่เป็นผู้ฉีดให้ทราบด้วย เนื่องจากบุคคลเหล่านี้จะห้ามฉีดวัคซีนแอสทราเซเนกาและวัคซีนแจนเซน (ตามข้อความในเอกสารที่เป็นข้อมูลผลิตภัณฑ์)
6. วัคซีนโควิด-19 ที่มีใช้อยู่เป็นชนิดฉีดเข้ากล้ามเนื้อ ด้วยเหตุนี้ผู้ที่มีภาวะเกล็ดเลือดต่ำ, ผู้ที่เป็นโรคเลือด เช่น โรคฮีโมฟีเลีย (hemophilia), ผู้ที่มีความผิดปกติเกี่ยวกับเลือดแข็งตัวช้า, ตลอดจนผู้ที่ได้รับยาต้านการแข็งตัวของเลือด ให้แจ้งบุคลากรทางการแพทย์ที่เป็นผู้ฉีด เพื่อการระมัดระวังถึงการเกิดภาวะเลือดออกหรือรอยจ้ำเขียวบริเวณที่ฉีด
7. วัคซีนโควิด-19 ไม่มีผลกระทบต่อประสิทธิภาพในการทำงานที่ต้องใช้ความระมัดระวัง เช่น การขับรถ หรือการทำงานเกี่ยวกับเครื่องจักรกล อย่างไรก็ตามอาการบางอย่างที่เกิดช่วงแรกภายหลังการฉีดวัคซีนอาจมีผลกระทบชั่วคราวได้ หรืออาการทั่วไปที่เกิดกับระบบทั่วร่างกาย เช่น ร่างกายอ่อนล้า ปวดศีรษะ ปวดข้อ ปวดกล้ามเนื้อ เป็นอยู่หลายวัน ด้วยเหตุนี้ควรรอให้สภาพร่างกายเป็นปกติก่อนจึงกลับไปทำงานที่ต้องใช้ความระมัดระวังสูง
8. ยังไม่มีการศึกษาถึงประสิทธิภาพของวัคซีนโควิด-19 ในผู้ที่มีภาวะภูมิคุ้มกันบกพร่องหรือผู้ที่ได้รับยากดภูมิคุ้มกัน ซึ่งประสิทธิภาพของวัคซีนในการกระตุ้นภูมิคุ้มกันในบุคคลเหล่านี้อาจเกิดได้ไม่เต็มที่
9. วัคซีนทุกชนิดล้วนมีข้อจำกัดที่ว่าอาจไม่ได้กระตุ้นให้ผู้รับวัคซีนทุกรายสร้างภูมิคุ้มกันที่เพียงพอ นอกจากนี้วัคซีนแต่ละชนิดจะมีประสิทธิภาพเต็มที่ในการกระตุ้นภูมิคุ้มกันเมื่อฉีดครบจำนวนเข็มตามที่กำหนดแล้วระยะหนึ่ง ซึ่งอาจใช้เวลา 1-2 สัปดาห์หลังจากฉีดเข็มสุดท้าย
10. ยังไม่มีข้อมูลที่ชัดเจนว่าวัคซีนจะกระตุ้นให้ร่างกายสร้างภูมิคุ้มกันในการป้องกันโรคได้มากและนานเพียงใด ด้วยเหตุนี้ช่วงที่การระบาดของโรคยังดำเนินอยู่ควรใช้มาตรการอื่นในการป้องกันโรคร่วมด้วย ได้แก่ ใส่หน้ากากอนามัย รักษาระยะห่าง หมั่นล้างมือบ่อย ๆ ปิดปากและจมูกเมื่อไอหรือจามด้วยทิชชู ทิ้งทิชชูที่ใช้แล้วลงถังขยะที่ปิดมิดชิด ไม่อยู่ในสถานที่ที่มีคนจำนวนมาก และให้อยู่ในสถานที่ซึ่งมีอากาศถ่ายเทดี
แหล่งอ้างอิง/ที่มา
- Centers for Disease Control and Prevention (CDC). US Department of Health and Human Services. Selected adverse events reported after COVID-19 vaccination, updated September 14, 2021. https://www.cdc.gov/coronavirus/2019-ncov/vaccines/safety/adverse-events.html#print. Accessed: September 17, 2021.
- Klugar M, Riad A, Mekhemar M, Conrad J, Buchbender M, Howaldt HP, et al. Side effects of mRNA-based and viral vector-based COVID-19 vaccines among German healthcare workers. Biology 2021. doi: 10.3390/biology10080752. Accessed: September 17, 2021.
- Centers for Disease Control and Prevention (CDC). US Department of Health and Human Services. Allergic reactions including anaphylaxis after receipt of the first dose of Pfizer-BioNTech COVID-19 vaccine--United States, December 14-23, 2020. https://www.cdc.gov/mmwr/volumes/70/wr/mm7002e1.htm#T2_down. Accessed: September 17, 2021.
- Shimabukuro T. Update: thrombosis with thrombocytopenia syndrome (TTS) following COVID-19 vaccination. Advisory Committee on Immunization Practices (ACIP), May 12, 2021. https://www.cdc.gov/vaccines/acip/meetings/downloads/slides-2021-05-12/07-COVID-Shimabukuro-508.pdf. Accessed: September 17, 2021.
- European Medicines Agency (EMA). AstraZeneca’s COVID-19 vaccine: EMA finds possible link to very rare cases of unusual blood clots with low bloodplatelets. https://www.ema.europa.eu/en/news/astrazenecas-covid-19-vaccine-ema-finds-possible-link-very-rare-cases-unusual-blood-clots-low-blood. Accessed: September 17, 2021.
- Centers for Disease Control and Prevention (CDC). Safety of COVID-19 vaccines, updated September 13, 2021. https://www.cdc.gov/coronavirus/2019-ncov/vaccines/safety/safety-of-vaccines.html. Accessed: September 17, 2021.
- Comirnaty (COVID-19 vaccine, mRNA) suspension for injection, for intramuscular use. Highlights of prescribing information, revised: August 2021. https://www.fda.gov/media/151707/download. Accessed: September 17, 2021.
- Fact sheet for healthcare providers administering vaccine (vaccination providers) emergency use authorization (EUA) of the Moderna COVID-19 vaccine to prevent coronavirus disease 2019 (COVID-19), revised: August 27, 2021. https://www.fda.gov/media/144637/download. Accessed: September 17, 2021.
- Fact sheet for healthcare providers administering vaccine (vaccination providers) emergency use authorization (EUA) of the Janssen COVID-19 vaccine to prevent coronavirus disease 2019 (COVID-19), revised: August 27, 2021. https://www.fda.gov/media/146304/download. Accessed: September 17, 2021.
- Comirnaty concentrate for dispersion for injection -- summary of product characteristics, updated: September 16, 2021. https://www.ema.europa.eu/en/documents/product-information/comirnaty-epar-product-information_en.pdf. Accessed: September 17, 2021.
- Spikevax dispersion for injection -- summary of product characteristics, updated August 24, 2021. https://www.ema.europa.eu/en/documents/product-information/spikevax-previously-covid-19-vaccine-moderna-epar-product-information_en.pdf. Accessed: September 17, 2021.
- COVID-19 vaccine Janssen suspension for injection -- summary of product characteristics, updated: September 6, 2021. https://www.ema.europa.eu/en/documents/product-information/covid-19-vaccine-janssen-epar-product-information_en.pdf. Accessed: September 17, 2021.
- Vaxzevria suspension for injection -- summary of product characteristics, updated: September 15, 2021. https://www.ema.europa.eu/en/documents/product-information/vaxzevria-previously-covid-19-vaccine-astrazeneca-epar-product-information_en.pdf. Accessed: September 17, 2021.
- European Medicines Agency (EMA). Comirnaty (Pfizer-BioNTech COVID-19 vaccine) safety update, September 8, 2021. https://www.ema.europa.eu/en/documents/covid-19-vaccine-safety-update/covid-19-vaccine-safety-update-comirnaty-8-september-2021_en.pdf. Accessed: September 17, 2021.
- European Medicines Agency (EMA). Spikevax (Moderna COVID-19 vaccine) safety update, September 8, 2021. https://www.ema.europa.eu/en/documents/covid-19-vaccine-safety-update/covid-19-vaccine-safety-update-spikevax-previously-covid-19-vaccine-moderna-8-september-2021_en.pdf. Accessed: September 17, 2021.
- European Medicines Agency (EMA). Vaxzevria (AstraZeneca COVID-19 vaccine) safety update, September 8, 2021. https://www.ema.europa.eu/en/documents/covid-19-vaccine-safety-update/covid-19-vaccine-safety-update-vaxzevria-previously-covid-19-vaccine-astrazeneca-8-september-2021_en.pdf. Accessed: September 17, 2021.
- European Medicines Agency (EMA). Janssen COVID-19 vaccine safety update, September 8, 2021. https://www.ema.europa.eu/en/documents/covid-19-vaccine-safety-update/covid-19-vaccine-safety-update-covid-19-vaccine-janssen-8-september-2021_en.pdf. Accessed: September 17, 2021.
- Danish Medicines Agency. Danish Medicines Agency investigates a case of inflammatory condition reported after COVID-19 vaccination, August 26, 2021. https://laegemiddelstyrelsen.dk/en/news/2021/danish-medicines-agency-investigates-a-case-of-inflammatory-condition-reported-after-covid-19-vaccination/. Accessed: September 17, 2021.
- European Medicines Agency (EMA). Meeting highlights from the Pharmacovigilance Risk Assessment Committee (PRAC) 30 August - 2 September 2021: COVID-19 vaccines: EMA reviewing cases of multisystem inflammatory syndrome. https://www.ema.europa.eu/en/news/meeting-highlights-pharmacovigilance-risk-assessment-committee-prac-30-august-2-september-2021. Accessed: September 17, 2021.
บทความที่ถูกอ่านล่าสุด

|
ท้องผูกและการใช้ยาระบาย 3 วินาทีที่แล้ว |

|
ยาทาสเตียรอยด์สำหรับโรคผิวหนัง 4 วินาทีที่แล้ว |

|
อันตรายจากยาตกค้างในสิ่งแวดล้อม 9 วินาทีที่แล้ว |
|
ยาปนเปื้อนในผลิตภัณฑ์เสริมอาหารและแนวทางการป้องกันตนเอง 9 วินาทีที่แล้ว |
|
ยาเม็ดคุมกำเนิด : ข้อควรระวังเมื่อใช้ร่วมกับยาอื่นที่รบกวนประสิทธิภาพและความปลอดภัย 11 วินาทีที่แล้ว |

|
ความเครียด และวิธีแก้ความเครียด 13 วินาทีที่แล้ว |

|
การผสมยาปฏิชีวนะชนิดผงแห้งสำหรับรับประทาน 1 นาทีที่แล้ว |

|
คุณและโทษของผลิตภัณฑ์ทำความสะอาดผสมสารต้านเชื้อแบคทีเรีย 1 นาทีที่แล้ว |

|
การนอน .. เพื่อชะลอวัยและเพื่อสุขภาพ 1 นาทีที่แล้ว |

|
ผลิตภัณฑ์นมจากพืชกับการใช้บริโภคทดแทนนมวัว 1 นาทีที่แล้ว |
