
|
อาจารย์ ดร.ภก.อนันต์ชัย อัศวเมฆิน ภาควิชาเภสัชวิทยา คณะเภสัชศาสตร์ มหาวิทยาลัยมหิดล |
|
| 22,560 ครั้ง เมื่อ 1 ช.ม.ที่แล้ว | |
| 2016-12-04 |
การคัดเลือกยานอกจากจะต้องคำนึงถึงความต้องการใช้ยาของแพทย์ นโยบาย และงบประมาณแล้ว ยังต้องสอดคล้องตามหลักกฎหมายด้วย โดยร่างพระราชบัญญัติว่าด้วยการจัดซื้อจัดจ้างและการบริหารพัสดุภาครัฐ ซึ่งกำลังอยู่ในช่วงการพิจารณาและจะมีผลบังคับใช้กำหนดให้การจัดซื้อจัดจ้างและการบริหารพัสดุภาครัฐจะต้องมีกรอบการปฏิบัติงานที่เป็นมาตรฐานเดียวกัน ซึ่งรวมถึงกรอบการจัดซื้อจัดจ้างด้วยวิธีประกวดราคาอิเล็กทรอนิกส์ (e-bidding) และการประเมินค่าประสิทธิภาพต่อราคา (price performance) นอกจากนี้จะต้องเปิดเผยข้อมูลและการดำเนินการอย่างโปร่งใสภายใต้การแข่งขันอย่างเป็นธรรม ตลอดจนคำนึงถึงความคุ้มค่าและมีการวางแผนประเมินผลการปฏิบัติเพื่อให้การจัดซื้อจัดจ้างมีประสิทธิภาพและประสิทธิผล
จากข้อกฎหมายดังกล่าวทำให้กระบวนการจัดซื้อยาจะต้องมีระเบียบวิธีที่ชัดเจนและพร้อมตรวจสอบได้ หากได้รับการร้องขอจากหน่วยงานที่เกี่ยวข้อง เช่น สำนักงานการตรวจเงินแผ่นดิน (สตง.) และคณะกรรมการป้องกันและปราบปรามการทุจริตแห่งชาติ (ป.ป.ช.) ดังนั้น กระบวนการคัดเลือกยาจำเป็นต้องทำอย่างเคร่งครัด โดยต้องคำนึงถึงความซับซ้อนและระดับการเลียนแบบของยาในแต่ละประเภทและประเมินความเท่าเทียมกันของผลการรักษา (therapeutic equivalence: TE) สืบเนื่องจากการที่ทะเบียนตำรับยามีอายุใช้ได้ตลอดระยะเวลาที่ได้รับใบอนุญาต อาจทำให้เกิดปัญหาด้านคุณภาพมาตรฐานจากการที่ผู้ผลิตไม่จำเป็นต้องปรับปรุงคุณภาพตามเกณฑ์มาตรฐานในการควบคุมยา ด้วยเหตุนี้จึงควรมีการจัดทำข้อมูลคุณภาพยาสำหรับการจัดซื้อของผู้ซื้อที่ต้องมีการสอบทวนข้อมูลที่จำเป็นในการพิสูจน์ความเท่าเทียมกันของการรักษาที่แตกต่างกันในแต่ละยี่ห้อยา โดยมีวัตถุประสงค์เพื่อแจ้งเสนอให้สำนักงานคณะกรรมการอาหารและยา (อย)
หลักเกณฑ์ที่ดีในการจัดซื้อยาที่มีมาตรฐาน (Good Procurement Practice: GPP) เป็นการสะท้อนถึงการประกันคุณภาพตามมาตรฐานตลอดวงจรชีวิตของผลิตภัณฑ์ยาที่กำหนดให้ผู้ผลิตต้องผลิตยาที่มีคุณภาพ ส่งข้อมูลยาในกระบวนการขึ้นทะเบียนตํารับกับทาง อย. ซึ่งจะพิจารณาทั้งมาตรฐานการผลิต คุณภาพของยา ความปลอดภัย และประสิทธิภาพ หากมีข้อมูลใหม่เกี่ยวกับยาที่ขึ้นทะเบียนแล้วหลังวางตลาดก็จะมีการปรับเกณฑ์ ข้อกำหนดของการขึ้นทะเบียน ซึ่งอาจปรับตามข้อมูลล่าสุดโดยผู้ผลิตยาต้นแบบหรืออ้างอิงตามข้อมูลจากองค์กรควบคุมยาในต่างประเทศ (FDA, EMA, PMDA และ TGA) ด้วยเหตุนี้การจัดซื้อยาจึงต้องพิจารณาจากข้อมูลที่เป็นปัจจุบันที่สุด แต่ต้องยึดโยงกับมาตรฐานที่เคยขึ้นทะเบียนไว้ โดยทางโรงพยาบาลสามารถขอข้อมูลเกี่ยวกับยาจากทางผู้ผลิต เพื่อเป็นการตรวจสอบว่าผู้ผลิตได้มีการปรับปรุงข้อมูลทางมาตรฐานของยานั้นหรือไม่
จากเหตุผลดังกล่าวทำให้การกำหนด Specific Drug TOR หรือข้อกำหนดรายละเอียดในการจัดซื้อยาตามคุณลักษณะเฉพาะของยาจะต้องได้ข้อมูลมาจากข้อมูลการขึ้นทะเบียนยา วิทยาการปัจจุบัน และข้อมูลที่มีการรายงานไว้ ต่างจากการจัดซื้อที่ผ่านมาที่เพียงอ้างอิงตามการพิจารณาจากราคาต่ำสุดและข้อกำหนดคุณลักษณะของยาเท่านั้น ยาแต่ละชนิดมีต้นทุนยาที่แตกต่างกัน เนื่องจากข้อมูลที่จำเป็นต้องใช้ในการขึ้นทะเบียนแตกต่างกัน ยาที่ขึ้นทะเบียนมานานแล้วอาจมีข้อมูลไม่เพียงพอที่จะพิสูจน์ TE ด้วยเหตุนี้การคัดเลือกยาควรประเมินจาก price performance แทนการคัดเลือกจากราคาต่ำสุดเพื่อให้ได้ยาที่มีคุณภาพตามที่ต้องการ โดยเฉพาะการจัดซื้อยากลุ่มชีววัตถุ (biological drugs) นั้นไม่สามารถกำหนดคุณลักษณะเฉพาะในการจัดซื้อโดยอาศัยกฎข้อใดข้อหนึ่งเพียงข้อเดียว แต่ต้องพิจารณาเกณฑ์ที่เหมาะสมตามประเภทของยาชีววัตถุนั้น
ข้อมูลดังกล่าวชี้ให้เห็นว่าการจัดซื้อยาสามัญแต่ละกลุ่มมีกระบวนการที่คล้ายกัน แต่มีเกณฑ์การคัดเลือกที่ต่างกัน คุณสมบัติการใช้แทนกันได้ (interchangeability) ของยาจะลดลงโดยผกผันตามความซับซ้อนด้านโครงสร้างของตัวยา และกระบวนการผลิตที่สูงขึ้นจนถึงระดับที่ไม่สามารถใช้แทนกันได้ และจำเป็นต้องพิสูจน์คุณสมบัติของยาใหม่ทั้งหมด ซึ่งยาเลียนแบบแต่ละกลุ่มมีเกณฑ์สำหรับพิสูจน์ TE ที่ต่างกัน การกำหนดคุณลักษณะเฉพาะในการจัดซื้อยาจำเป็นต้องพิจารณาให้สอดคล้องกับเกณฑ์ที่เหมาะสมสำหรับยาแต่ละชนิด
สำหรับกลุ่มยาเคมีที่ต้องการนำมาใช้แทนยาต้นแบบ (generic drugs) จะต้องพิสูจน์ว่าเป็นยาตัวเดียวกัน ผลิตจากโรงงานที่ดีมีคุณภาพมาตรฐาน และเมื่อเทียบกันแล้วต้องมี PE (pharmaceutical equivalence: ความเท่าเทียมทางเภสัชกรรม), BE (bioequivalence: ชีวสมมูล) ที่เท่าเทียมกัน โดยมีหลักการว่าสามารถยกเว้นข้อมูลด้าน in vivo BE สำหรับยาในกลุ่ม BCS Class 1 (High solubility – High permeability) อนึ่ง ยาที่ขอเฉพาะข้อมูล PE แต่ไม่ขอข้อมูล BE แสดงให้เห็นว่ายานั้นสามารถเลียนแบบและพิสูจน์ interchangeability ได้ง่าย ต่างจากยาที่ซับซ้อนซึ่งจำเป็นต้องมีข้อมูลเพิ่มเติม ได้แก่ toxicity, in vivo clinical PK, in vivo clinical PD รวมไปถึง clinical efficacy studies ตามลำดับ
กลุ่มยา non-biologic complex drugs และกลุ่มยาชีววัตถุมีความซับซ้อนมากกว่ากลุ่มยาเคมี จึงจำเป็นต้องจำแนกเกณฑ์การคัดเลือกยาที่สามารถใช้แทนกันได้เป็น 3 ชุดแตกต่างไปตามยาแต่ละกลุ่ม แต่ไม่ว่าจะเป็นยากลุ่มใดก็ตาม ต้องสามารถพิสูจน์ได้ว่าเป็นผลิตภัณฑ์ที่สามารถทดแทนกันได้ (interchangeable product)
ดังนั้น การจัดซื้อยาตามกฎหมายฉบับปัจจุบันคือ การจัดหายาคุณภาพ ราคาเหมาะสมที่มีความเท่าเทียมกันของประสิทธิผลในการรักษา มีการแข่งขันอย่างเป็นธรรม โปร่งใส คุ้มค่า มีประสิทธิภาพ ตรวจสอบได้ โดยต้องคำนึงถึงข้อมูลของยาที่ขึ้นทะเบียนมาก่อนหน้านี้ และวิทยาการปัจจุบันที่เปลี่ยนแปลงไปตลอดช่วงอายุของยา ดังนั้น หากมีการขอแก้ไขทะเบียนตำรับยาก็ควรที่จะต้องขอเอกสารการแก้ไขทะเบียนตำรับยาที่ผู้ผลิตยื่นแก้ไขเปลี่ยนแปลงต่อสำนักงานคณะกรรมการอาหารและยาด้วย
การคัดเลือกข้อเสนอตามร่างพระราชบัญญัติจัดซื้อจัดจ้างฉบับใหม่ มีเกณฑ์หลักประกอบด้วย
แนวทางการจัดซื้อในปัจจุบันสามารถกำหนดตามตัวแปรหลัก 2 ประการ ขึ้นอยู่กับการจัดอันดับความสำคัญระหว่างปัจจัยด้านราคาที่เสนอ (price) และประสิทธิภาพต่อราคา (price performance) โดยสอดคล้องตามหลักกฎหมายและวิชาการ ดังนี้
การคัดเลือกยาต้องปฏิบัติให้สอดคล้องกับกรอบวิธีประกวดราคาอิเล็กทรอนิกส์ตามหลักกฎหมายและวิชาการ อันประกอบด้วย 1. เกณฑ์การประเมิน TE ของยา (GPP model) 2. กระบวนการคัดเลือก และ 3. เครื่องมือในการคัดเลือก เพื่อให้สอดคล้องกับหลักการสำคัญตามมาตรา 8 ในร่างพระราชบัญญัติจัดซื้อจัดจ้างและการบริหารพัสดุภาครัฐ ได้แก่
- คุ้มค่า โดยพัสดุที่จัดซื้อจัดจ้างต้องมีคุณภาพหรือคุณลักษณะที่ตอบสนองวัตถุประสงค์ในการใช้งานของหน่วยงานของรัฐ มีราคาที่เหมาะสม และมีแผนการบริหารพัสดุที่เหมาะสมและชัดเจน
- โปร่งใส โดยการจัดซื้อจัดจ้างและการบริหารพัสดุต้องกระทำโดยเปิดเผย เปิดโอกาสให้มีการแข่งขันอย่างเป็นธรรม มีการปฏิบัติต่อผู้ประกอบการทุกรายโดยเท่าเทียมกัน มีหลักฐานการดำเนินงานชัดเจน และมีการเปิดเผยข้อมูลการจัดซื้อจัดจ้างและการบริหารพัสดุในทุกขั้นตอน
- มีประสิทธิภาพและประสิทธิผล โดยต้องมีการวางแผนการจัดซื้อจัดจ้างและการบริหารพัสดุล่วงหน้า เพื่อให้การจัดซื้อจัดจ้างและการบริหารพัสดุเป็นไปอย่างต่อเนื่อง และมีการประเมินและเปิดเผยผลสัมฤทธิ์ของการจัดซื้อจัดจ้างและการบริหารพัสดุ
- ตรวจสอบได้ โดยมีการเก็บข้อมูลการจัดซื้อจัดจ้างและการบริหารพัสดุอย่างเป็นระบบเพื่อประโยชน์ในการตรวจสอบ
โดยมีมาตรา 12 กำกับไว้อย่างชัดเจนว่า
“หน่วยงานของรัฐต้องจัดให้มีการบันทึกรายงานรายละเอียด วิธีการและขั้นตอนการจัดซื้อจัดจ้างและจัดเก็บไว้อย่างเป็นระบบ เพื่อประโยชน์ในการตรวจดูข้อมูลเมื่อมีการร้องขอ”
กระบวนการจัดซื้อจึงสามารถนำมาวิเคราะห์ด้วยวิธี Multi-Criteria Decision Analysis (MCDA) ซึ่งมีประโยชน์ในจัดการข้อมูลประกอบการตัดสินใจในการจัดซื้อมีขั้นตอนที่ชัดเจน คือ
- กำหนดเกณฑ์การตัดสินใจ
- กำหนดลำดับความสำคัญของเกณฑ์
- กำหนดอำนาจการแยกตามเกรด
- รวบรวมข้อมูลและสังเคราะห์ตามเกณฑ์แต่ละด้าน
- คำนวณความสำคัญและเกรดของผลิตภัณฑ์แต่ละตัว
- จัดลำดับผลิตภัณฑ์
- ตัดสินใจ
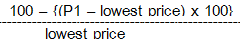
กรอบการวิเคราะห์ MCDA จะช่วยตอบได้ว่าจะต้องใช้เกณฑ์ใดหากพิจารณาจาก price เพียงอย่างเดียว (price + minimum requirement ของยาโดยไม่ประเมิน performance grading) โดยใช้ข้อกำหนดคุณลักษณะ (specification) เป็น knock-out criteria หรือพิจารณาจาก price performance (price + minimum requirement ร่วมกับการประเมิน performance grading) โดยใช้ performance criteria เป็น grading criteria เนื่องจาก price และ minimum requirement ไม่เพียงพอที่จะแบ่งเกรดยาได้ กลุ่มยาที่ไม่ซับซ้อนอาจประเมินด้วย price เพียงอย่างเดียวได้ ต่างจากกลุ่มยาที่ซับซ้อนที่ควรใช้ price performance ประกอบการคัดเลือก สัดส่วนของ price และ price related สามารถพิจารณาจากสัดส่วนของคุณสมบัติที่เกี่ยวข้องกับผลิตภัณฑ์ (product related [%P]) และผลลัพธ์ต่อสุขภาพ (health outcome [%H]) ที่กำหนด TE อันเป็นวัตถุประสงค์ในการจัดซื้อยา การนำกรอบ MCDA ในการคัดเลือกโดยพิจารณาจาก price เพียงอย่างเดียวเริ่มต้นจากการกำหนดกรอบของการจัดซื้อ และเกณฑ์การคัดเลือกโดยใช้เฉพาะกับกลุ่มยาเคมี จากนั้นจึงจัดทำเป็น Specific Drug TOR โดยเกี่ยวโยงกับตัวยาเพื่อนำไปคัดเลือกยาตามชื่อการค้า ส่วนการนำกรอบ MCDA ในการคัดเลือกจาก price performance จะต้องพิจารณาก่อนว่าเป็นยากลุ่มใด และระบุชุดของเกณฑ์การคัดเลือก จากนั้นจึงจัดทำ Specific Drug TOR โดยระบุน้ำหนักการคัดเลือกจาก price และ price performance ตาม %P และ %H แล้วจึงคัดเลือกตัวยาและยี่ห้อยาตามลำดับ โดยมีขั้นตอนดังนี้
- ระบุว่ายาอยู่ในกลุ่มใด
- ประเมินระดับความซับซ้อนของข้อกำหนดในการเลียนแบบยาตาม %P
- ประเมินความสำคัญทางคลินิกของยา (vital drugs, essential drugs หรือ non-essential drugs) เพื่อกำหนด % price performance
- จัดทำกราฟคะแนนของยาตาม grading criteria เพื่อเปรียบเทียบ price performance
- คำนวณราคาด้วยสูตร
ผลิตภัณฑ์นั้นจะไม่ได้คะแนนในส่วนของราคาหากผลลัพธ์ > 2 เท่าของราคาต่ำสุดที่เสนอ อนึ่ง การกำหนดเพดานราคาด้วยสูตรนี้ไม่ทำให้ราคายาสูงขึ้นโดยควบคุมไม่ได้ในกรณีคัดเลือกจาก price performance การเปิดโอกาสให้มีสัดส่วนประสิทธิภาพ (% performance) ต่อราคา (% price) ที่ยืดหยุ่นจะช่วยสะท้อนคุณค่าและผลลัพธ์การรักษาที่แท้จริงจากผลิตภัณฑ์ ปัจจุบัน e-bidding เริ่มเป็นที่แพร่หลายมากขึ้น และแต่ละโรงพยาบาลก็มีสัดส่วนของ price และ performance ที่แตกต่างกัน ส่วนใหญ่มีสัดส่วน price และ performance อยู่ที่ 30-70
แหล่งอ้างอิง/ที่มา
- Barrangou, Rodolphe, and Jennifer A Doudna. 2016. "Applications of CRISPR Technologies in Research and beyond." Nature Biotechnology 34(9): 933–41. http://www.nature.com/doifinder/10.1038/nbt.3659
- "CRISPR-Cas9 Based Therapeutics: Not So Fast." 2015. EBioMedicine 2(5): 365.
- Lander, Eric S. 2016. “The Heroes of CRISPR.” Cell 164(1–2): 18–28. http://dx.doi.org/10.1016/j.cell.2015.12.041
-->
บทความที่ถูกอ่านล่าสุด
|
ยาเม็ดคุมกำเนิดชนิดฮอร์โมนรวม 2 วินาทีที่แล้ว |

|
กระชายดำกับสมรรถภาพทางเพศชาย 15 วินาทีที่แล้ว |

|
ยารักษาโรคเบาหวาน ใช้อย่างไร 19 วินาทีที่แล้ว |

|
เมล็ดเจีย/เมล็ดเชีย (Chia seed) ลดน้ำหนักได้ ? 26 วินาทีที่แล้ว |
|
ยาแก้ปวดข้อ ข้ออักเสบ-กลุ่มเอ็นเสด (NSAIDs) 1 นาทีที่แล้ว |

|
ไม้ประดับมีพิษ….คิดสักนิดก่อนจะปลูก 1 นาทีที่แล้ว |

|
ยาแก้วิงเวียน ระวัง! อย่าใช้พร่ำเพรื่อ 2 นาทีที่แล้ว |

|
น้ำมันหอมระเหย...ชีวิตนี้ขาดเธอไม่ได้ 2 นาทีที่แล้ว |

|
ผักชีของไทย..ดังไกลถึงญี่ปุ่น..แล้วประโยชน์คืออะไร 2 นาทีที่แล้ว |

|
ยาที่ไม่ควรกินร่วมกับเครื่องดื่มแอลกอฮอล์ 2 นาทีที่แล้ว |
