|
ผศ.ดร.ภกญ. ปิยนุช โรจน์สง่า ภาควิชาเภสัชเคมี และ ภกญ. รุ้งลาวัลย์ ตันติวัฒนกูล สถานปฏิบัติการเภสัชกรรมชุมชน คณะเภสัชศาสตร์ มหาวิทยาลัยมหิดล |
|
| 16,661 ครั้ง เมื่อ 5 ช.ม.ที่แล้ว | |
| 2018-07-22 |
ยารักษาโรคจัดเป็นหนึ่งในปัจจัยสี่ที่มีความสำคัญต่อการดำรงชีวิตของมนุษย์ การใช้ยาให้เกิดประสิทธิภาพสูงสุดนั้นเกี่ยวข้องกับทั้งการเลือกใช้ยาให้ถูกโรค ยาที่ใช้มีคุณภาพมาตรฐานที่ดีและไม่ก่อให้เกิดความเป็นพิษ การควบคุมคุณภาพยาจึงเข้มงวดและประกอบด้วยหลายขั้นตอน ตั้งแต่การควบคุมคุณภาพวัตถุดิบตัวยาสำคัญ ส่วนประกอบต่างๆ และผลิตภัณฑ์ยา โดยมีการควบคุมทั้งปริมาณตัวยาสำคัญให้อยู่ในเกณฑ์ที่กำหนดและปริมาณสารเจือปนไม่เกินเกณฑ์ที่กำหนด นอกจากนี้ยังมีการควบคุมคุณภาพในระหว่างกระบวนการผลิตอีกด้วย 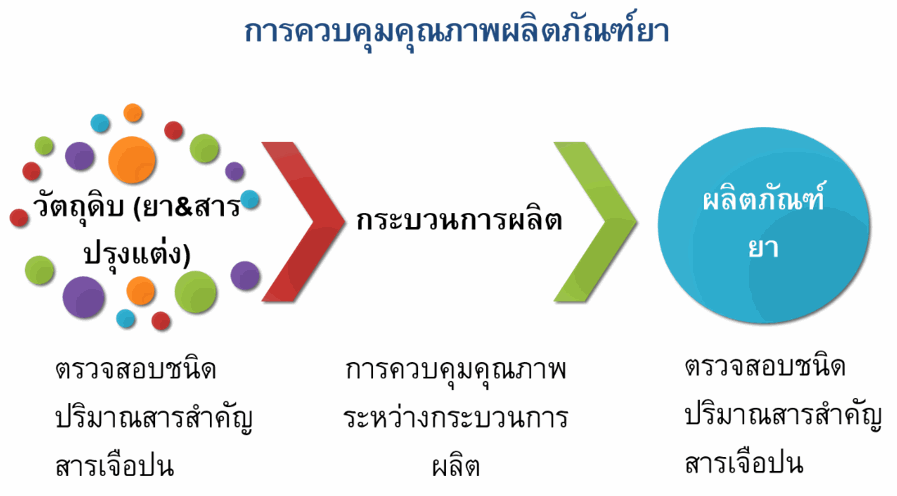
สารเจือปนในยา คือ สารที่ไม่ต้องการซึ่งพบในตัวยาสำคัญหรือในผลิตภัณฑ์ยา โดยสารเจือปนดังกล่าวอาจมีความเป็นพิษ หรือถ้าสารเจือปนนั้นเป็นสารสลายตัวของตัวยาสำคัญอาจส่งผลต่อประสิทธิภาพของผลิตภัณฑ์ยานั้นๆ ได้
สารเจือปนในวัตถุดิบยา อาจเกิดขึ้นระหว่างกระบวนการผลิตวัตถุดิบยา โดยใช้ปฏิกิริยาทางเคมีในการสังเคราะห์จากสารตั้งต้นซึ่งอาจทำให้เกิดสารเจือปนต่างๆได้เช่น สารตั้งต้นในปฏิกิริยาเคมี (starting materials) สารอื่นที่เกิดขึ้นในปฏิกิริยา (by-products) สารตัวกลางในปฏิกิริยาทางเคมี โลหะที่ใช้ในการเร่งปฏิกิริยาเคมี ตัวทำละลายที่ใช้ในการผลิต นอกจากนี้สารเจือปนที่พบในตัวยาสำคัญอาจเกิดจากการสลายตัวของยาดังกล่าวในระหว่างการเก็บรักษาการสังเคราะห์ยาหนึ่งๆสามารถทำได้หลายวิธีซึ่งแต่ละวิธีจะทำให้เกิดสารเจือปนในตัวยานั้นได้แตกต่างกัน
สารเจือปนในผลิตภัณฑ์ยา ส่วนใหญ่ที่พบมักเกิดจากการสลายตัวของตัวยาสำคัญซึ่งอาจเกิดขึ้นระหว่างกระบวนการผลิตหรือการเก็บรักษาผลิตภัณฑ์ยา สารเจือปนในยาอาจเป็นสารที่ทราบชนิดและความเป็นอันตรายหรือเป็นสารที่ไม่ทราบชนิดได้ โดยปริมาณสารเจือปนในยาที่พบต้องไม่เกินเกณฑ์ที่กำหนดไว้ในทะเบียนตำรับยาที่แจ้งไว้กับสำนักงานคณะกรรมการอาหารและยา และมีการระบุสารเจือปนประเภทตัวทำละลายที่ต้องหลีกเลี่ยง (Solvents to be avoided) ได้แก่ ตัวทำละลายที่มีอันตรายสูง เป็นสารก่อมะเร็งและเป็นพิษต่อสิ่งแวดล้อม ดังนั้นจึงไม่ควรใช้ตัวทำละลายประเภทนี้ในการผลิตวัตถุดิบตัวยาสำคัญ สารปรุงแต่ง และผลิตภัณฑ์ยา ในกรณีที่ไม่สามารถหลีกเลี่ยงได้จะต้องมีปริมาณตัวทำละลายตกค้างไม่เกินเกณฑ์ที่กำหนด เช่น benzene ซึ่งเป็นสารก่อมะเร็ง เป็นต้น (1-4) 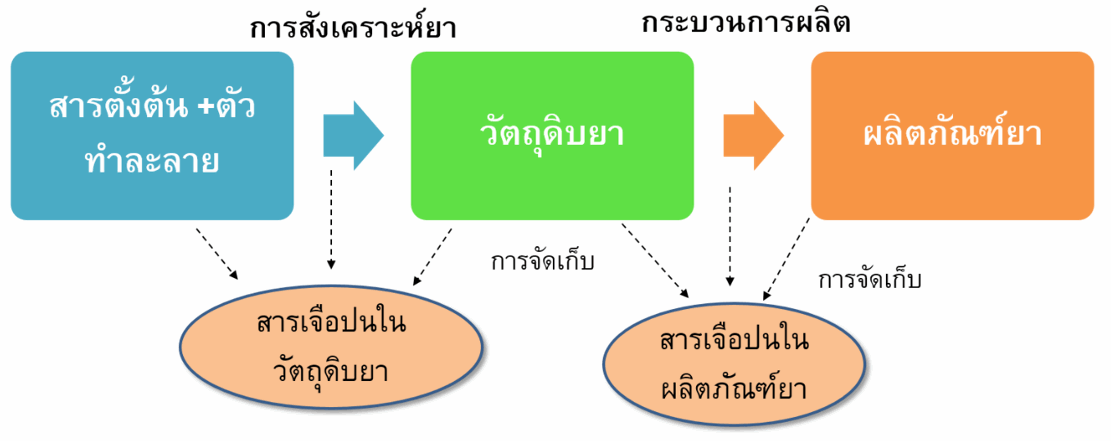
กรณีมีการเรียกคืนผลิตภัณฑ์ยาที่มีส่วนประกอบของ วาลซาร์แทน (Valsartan) จากท้องตลาดทั้งในสหรัฐอเมริกา และอีกหลายประเทศในสหภาพยุโรปร่วมทั้งประเทศไทย (5) เนื่องจากมีการตรวจพบสารเจือปน N-Nitrosodimethylamine (NDMA) ในผลิตภัณฑ์ยาที่ใช้วัตถุดิบตัวยาสำคัญวาลซาร์แทน จากบริษัท Zhejiang Huahai Pharmaceuticals สาธารณรัฐประชาชนจีน ทางบริษัทผู้ผลิตคาดว่าอาจเกิดจากการเปลี่ยนกระบวนการผลิตวัตถุดิบยา ทั้งนี้มีผลิตภัณฑ์ยาที่ได้รับอนุญาตจากสำนักงานคณะกรรมการอาหารและยาให้จำหน่ายในประเทศไทยรวมทุกความแรงทั้งสิน 38 ตำรับ โดยมีเพียง 5 ตำรับที่ถูกเรียกคืนเนื่องจากใช้วัตถุดิบยาวาลซาร์แทน จากบริษัท Zhejiang Huahai Pharmaceuticals (ตารางที่ 1) ทั้งนี้การปนเปื้อนสาร NDMA ไม่ได้เกิดจากกระบวนการผลิตผลิตภัณฑ์ยา ถ้าบริษัทผู้ผลิตยาทั้ง 5 ตำรับดังกล่าวสามารถแก้ไขการปนเปื้อนสาร NDMA ได้จะสามารถผลิตและจำหน่ายผลิตภัณฑ์ยาวาลซาร์แทนได้ตามปกติ (5)
ผู้ป่วยที่ได้รับผลิตภัณฑ์ยาที่มีส่วนประกอบของยาวาลซาร์แทน เพื่อใช้ในการรักษาโรคความดันโลหิตสูงหรือโรคหลอดเลือดหัวใจ ควรตรวจสอบผลิตภัณฑ์ยาที่ใช้ก่อนว่าตรงกับผลิตภัณฑ์ยาที่เรียกคืนหรือไม่ ไม่ควรหยุดยาเองหรือไม่จำเป็นต้องเปลี่ยนไปใช้ยาอื่น เนื่องจากสารก่อมะเร็งที่พบไม่ใช่ตัวยา วาลซาร์แทน แต่เป็นสารเจือปนที่มีโอกาศพบในผลิตภัณฑ์ยา 5 ตำรับดังแสดงในตารางที่ 1 โดยผลิตภัณฑ์ยาตำรับอื่นๆที่ไม่ได้ใช้วัตถุดิบจากบริษัทดังกล่าวยังสามารถใช้เพื่อการรักษาได้ตามปกติ นอกจากนี้ผู้ป่วยที่ได้รับยาในการรักษาโรคความดันโลหิตสูงอื่นๆเช่น amlodipine atenolol enalapril สามารถใช้ยาได้ตามปกติซึ่งไม่เกี่ยวข้องกับการเรียกคืนยา 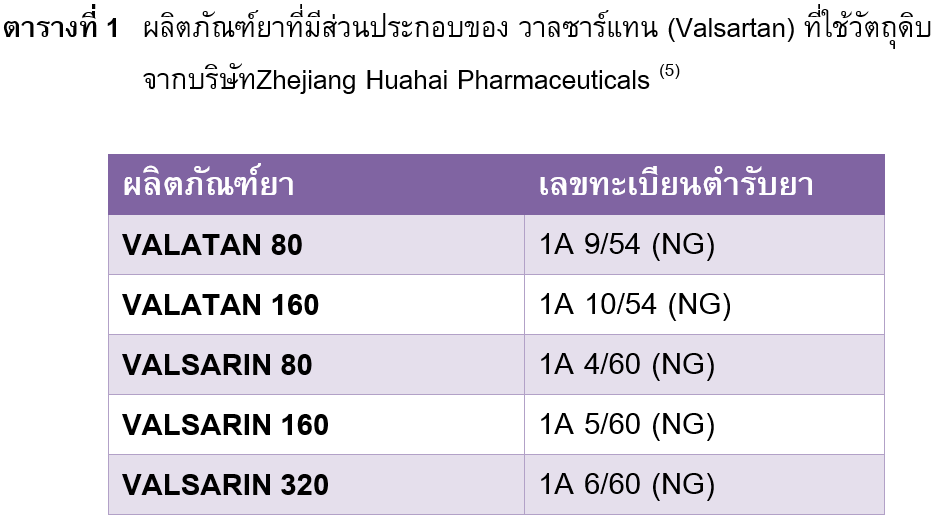
การตรวจสอบเลขทะเบียนตำรับยาที่รับประทานอยู่ว่าตรงกับผลิตภัณฑ์ยาที่เรียกคืนหรือไม่ สามารถสังเกตได้จาก ชื่อทางการค้าหรือยี่ห้อของยา (จุดที่ 1) นอกจากนี้ยังสามารถตรวจสอบได้จากเลขทะเบียนตำรับของผลิตภัณฑ์ (จุดที่ 2) ที่อยู่บริเวณข้างกล่องบรรจุภัณฑ์ โดยสามารถสังเกตได้ดังนี้ 
ทั้งนี้หากพบว่ายาที่ใช้มีชื่อทางการค้า หรือมีเลขทะเบียนตำรับที่ตรงกับผลิตภัณฑ์ยาที่ระบุในตารางที่ 1 ให้นำผลิตภัณฑ์ยาไปเปลี่ยน ณ โรงพยาบาล คลินิก หรือสถานพยาบาลที่ได้รับการจ่ายยาดังกล่าว หากยังไม่สามารถไปเปลี่ยนยาได้ ไม่ควรหยุดการใช้ยาทันที เนื่องจากการใช้ยาเพื่อรักษาโรคความดันโลหิตสูงซึ่งเป็นโรคเรื้อรังที่มีความจำเป็นต้องใช้ยาอย่างต่อเนื่อง ทั้งนี้ทางสำนักงานคณะกรรมการอาหารและยาระบุว่าจากการศึกษาข้อมูลความปลอดภัยย้อนหลัง ยังไม่พบว่าผู้ป่วยมีประเด็นการเกิดมะเร็งจากยานี้ที่ใช้วัตถุดิบจากสาธารณรัฐประชาชนจีน (5-7)
N-Nitrosodimethylamine (NDMA)เป็นสารอินทรีย์ที่ระเหยได้ จัดเป็นสารพิษที่ทำให้เกิดมะเร็งตับในหนูทดลอง NDMA เป็นสารที่เคยใช้ในการผลิตเชื้อเพลิงจรวด สารต้านอนุมูลอิสระ และสารให้ความเย็นสำหรับโคพอลิเมอร์ ปัจจุบันใช้เฉพาะเพื่อการวิจัยเท่านั้น นอกจากนี้ยังสามารถพบการปนเปื้อน NDMA ในอากาศ ดินและแหล่งน้ำใต้ดินได้อีกด้วย อย่างไรก็ตาม NMDA ถูกทำลายได้ง่ายโดยแสงแดดภายในเวลาไม่กี่นาที (7) 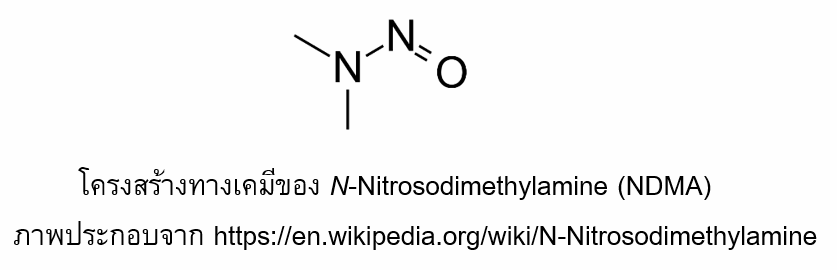
ทั้งนี้การจัด NDMA เป็นสารที่อาจก่อให้เกิดมะเร็งในมนุษย์อาศัยข้อมูลความเป็นพิษจากหนูทดลองเท่านั้นโดยยังไม่ปรากฎข้อมูลความเป็นพิษในมนุษย์ที่ชัดเจน (7) เมื่อมีรายงานการปนเปื้อนสารดังกล่าวในวัตถุดิบยาจึงต้องมีการเรียกคืนและระงับการใช้ผลิตภัณฑ์ยาที่มีการปนเปื้อนสาร NDMA เพื่อความปลอดภัยของผู้บริโภคนั้นเอง
แหล่งอ้างอิง/ที่มา
- ICH Q3A (R2): Impurities in New Drugs Substances. Quality Guideline: http://www.ich.org/fileadmin/Public_Web_Site/ICH_Products/Guidelines/Quality/Q3A_R2/Step4/Q3A_R2_Guideline.pdf
- ICH Q3B (R2): Impurities in New Drugs Product. Quality Guideline: http://www.ich.org/fileadmin/Public_Web_Site/ICH_Products/Guidelines/Quality/Q3B_R2/Step4/Q3B_R2_Guideline.pdf
- ICH Q3C (R6): Impurities: Guildline for Residual Solvents. Quality Guideline: http://www.ich.org/fileadmin/Public_Web_Site/ICH_Products/Guidelines/Quality/Q3C/Q3C_R6_Step_4.pdf
- ปิยนุช โรจน์สง่า. ข้อกำหนด International Council for Harmonization (ICH) Q3 Impurities. ใน: จุฑารัตน์ พิมพ์ทนต์, นันทนา นุชถาวร, กันตรัตน์ อรุณรุ่งวิเชียร, บรมพจน์ พฤฒิวนาสัณฑ์, บรรณาธิการ. International Council for Harmonization (ICH) สู่การปฏิบัติ. กรุงเทพฯ: พี.เอส.พริ้นท์; 2560. หน้า 54–80.
- อย. เรียกเก็บคืน “ยาวาลซาร์แทน (Valsartan)” หลังพบสารก่อมะเร็งในวัตถุดิบ. ข่าวประชาสัมพันธ์ กลุ่มสื่อสารองค์กร กองพัฒนาศักยภาพผู้บริโภค สำนักคณะกรรมการอาหารและยา. http://www.fda.moph.go.th/SitePages/News.aspx?IDitem=634 (Accessed July 18, 2018)
- Zhao, Y.-T.; Li, P.-Y.; Zhang, J.-Q.; Wang, L.; Yi, Z., Angiotensin II Receptor Blockers and Cancer Risk: A Meta-Analysis of Randomized Controlled Trials. Medicine 2016, 95 (18), e3600.
- แนวทางปฏิบัติสาหรับประชาชน กรณีเรียกเก็บคืน “ยาวาลซาร์แทน (Valsartan)” หลังพบสารก่อมะเร็งในวัตถุดิบ ข่าวประชาสัมพันธ์ กลุ่มสื่อสารองค์กร กองพัฒนาศักยภาพผู้บริโภค สำนักคณะกรรมการอาหารและยา. http://www.fda.moph.go.th/SitePages/News.aspx?IDitem=636 (Accessed July 18, 2018)
- Technical Fact Sheet –N-Nitroso-dimethylamine (NDMA). Available at https://www.epa.gov/sites/production/files/2017-10/documents/ndma_fact_sheet_update_9-15-17_508.pdf. (Accessed July 20, 2018).
บทความที่ถูกอ่านล่าสุด

|
หยุดคิดสักนิด…ก่อนคิดฝ่าไฟแดง 1 วินาทีที่แล้ว |
|
การใช้ยาในหญิงมีครรภ์ : ข้อแนะนำเพื่อหลีกเลี่ยงอันตรายต่อทารกในครรภ์ 19 วินาทีที่แล้ว |
|
โรคเกาต์กับเกาต์เทียม ต่างกันอย่างไร 19 วินาทีที่แล้ว |
|
ยาแก้ไอ ... มีกี่แบบ ?? 1 นาทีที่แล้ว |
|
การคุมกำเนิดฉุกเฉินด้วยห่วงอนามัย 1 นาทีที่แล้ว |

|
ผักผลไม้..ที่ควรระวังในผู้ป่วยโรคเรื้อรัง 1 นาทีที่แล้ว |
|
ยารักษาโรคเชื้อราที่เล็บ 1 นาทีที่แล้ว |
|
ผลแลปจากการตรวจเลือด....มีความหมายว่าอย่างไร 1 นาทีที่แล้ว |
|
ยาเม็ดคุมกำเนิดชนิดฮอร์โมนรวม 1 นาทีที่แล้ว |
|
โรคน้ำหนีบ (Decompression sickness) 2 นาทีที่แล้ว |
