
|
Eng |
ดร.ภก.อนันต์ชัย อัศวเมฆิน ภาควิชาเภสัชวิทยา คณะเภสัชศาสตร์ มหาวิทยาลัยมหิดล
ผลิตภัณฑ์ชีววัตถุเช่น อินซูลิน อีโปรอีติน โมโนโคนัลแอนติบอดี ฯลฯ มีการนำมาใช้รักษาโรคมานานพอควรและได้รับการยอมรับว่าสามารถรักษาโรคที่เป็นอันตรายถึงแก่ชีวิตรวมทั้งโรคเรื้อรังได้จริง อย่างไรก็ตามเนื่องด้วยต้นทุนที่สูง ผลิตภัณฑ์ดังกล่าวจึงมีข้อจำกัดในการเข้าถึงของผู้ป่วยโดยเฉพาะในประเทศที่กำลังพัฒนา แต่ไม่นานนี้สิทธิบัตรและ/หรือสัญญาการคุ้มครองข้อมูลของบรรดาผู้ผลิตภัณฑ์ชีววัตถุต้นแบบกลุ่มแรกที่ได้รับการขึ้นทะเบียนได้หมดอายุลง จึงเปิดทางให้มีการผลิตผลิตภัณฑ์ชีววัตถุคล้ายคลึง (biosimilars) กับผลิตภัณฑ์ต้นแบบ (originator) ขึ้น และเนื่องจากการผลิตผลิตภัณฑ์ชีววัตถุคล้ายคลึงกับผลิตภัณฑ์ต้นแบบไม่ต้องลงทุนวิจัยและพัฒนาผลิตภัณฑ์มากนัก จึงส่งผลให้ต้นทุนในการผลิตผลิตภัณฑ์ชีววัตถุคล้ายคลึงต่ำกว่าต้นทุนในการผลิตของผลิตภัณฑ์ต้นแบบ ราคาของผลิตภัณฑ์ชีววัตถุคล้ายคลึงกับผลิตภัณฑ์ต้นแบบจึงต่ำกว่ามาก ทำให้มีผู้ป่วยจำนวนมากขึ้นที่มีโอกาสได้ใช้ผลิตภัณฑ์เหล่านี้ แต่สิ่งสำคัญที่ไม่ควรมองข้ามคือการประเมินผลิตภัณฑ์ดังกล่าวเพื่ออนุมัติให้ใช้ในทางการแพทย์ ซึ่งข้อมูลบางส่วนได้อ้างอิงข้อมูลความปลอดภัยและประสิทธิผลจากผลิตภัณฑ์ต้นแบบที่ได้รับการขึ้นทะเบียนแล้ว นอกจากนี้ประสบการณ์ในการรักษาโรครวมทั้งข้อมูลความปลอดภัยของผลิตภัณฑ์ยาต้นแบบยังช่วยสนับสนุนการเกิดการพัฒนาผลิตภัณฑ์ยาชีววัตถุคล้ายคลึง ซึ่งปัจจุบันมีหลายหน่วยงานในโลกได้บัญญัติศัพท์หลากหลายกันไปเพื่อนิยามผลิตภัณฑ์ดังกล่าว เช่น ผลิตภัณฑ์ชีววัตถุที่มีลักษณะคล้ายกัน (similar biotherapeutics products, biosimilars) ผลิตภัณฑ์โปรตีนเลียนแบบ (follow-on protein products) และผลิตภัณฑ์ชีววัตถุที่ได้รับการนำเข้าสู่ท้องตลาดในภายหลัง (subsequent-entry biologics) ซึ่งยาชีววัตถุคล้ายคลึงจะหมายถึงผลิตภัณฑ์ชีววัตถุที่ได้จากการตัดต่อทางพันธุกรรมด้วยกระบวนการทางเทคโนโลยีชีวภาพ โดยต้องเป็นยาที่ได้รับการยอมรับอย่างแพร่หลาย และผ่านการตรวจสอบลักษณะอย่างดี (well-established and well-characterized biological medicinal products) ทั้งนี้ ไม่รวมถึง วัคซีน ผลิตภัณฑ์ที่ได้จากพลาสมา และอนาล็อกของวัคซีนหรือพลาสมาที่ได้จากการตัดต่อทางพันธุกรรม (recombinant analogues) ส่วนยาชีววัตถุที่ไม่เป็นทั้งผลิตภัณฑ์ยาต้นแบบและยาชีววัตถุคล้ายคลึงนั้นต้องการข้อมูลที่ครบถ้วนแบบเดียวกับยาชีววัตถุต้นแบบในการประเมินการขึ้นทะเบียนตำรับยา คำว่า ยา “สามัญ” นั้นเป็นคำที่ใช้อธิบายถึงผลิตภัณฑ์เคมีและผลิตภัณฑ์ที่มีส่วนประกอบของโมเลกุลขนาดเล็กซึ่งมีโครงสร้างและประสิทธิผลในการรักษาเทียบเท่ากับผลิตภัณฑ์ต้นแบบซึ่งสิทธิบัตรและ/หรือสัญญาการคุ้มครองข้อมูลของการผลิตได้หมดอายุลง วิธีการและข้อมูลที่ถูกกำหนดให้ยื่นต่อองค์กรที่ประเมินและอนุมัติการใช้ยาเพื่อแสดงให้เห็นว่ายาสามัญมีความสมมูลทางการรักษา (therapeutic equivalence) กับผลิตภัณฑ์อ้างอิงมักจะเหมาะสม และเพียงพอที่จะรับรองประสิทธิผลที่เทียบเท่าระหว่างยาสามัญกับผลิตภัณฑ์อ้างอิง
แต่แนวทางที่เคยกำหนดขึ้นสำหรับเปรียบเทียบความสมมูลทางการรักษาของยาสามัญนั้นไม่สามารถนำมาใช้กับการพัฒนา การประเมิน และการขึ้นทะเบียนผลิตภัณฑ์ยาชีววัตถุคล้ายคลึงทั้งนี้เพราะลักษณะโมเลกุลของยาชีววัตถุ แบ่งออกเป็นแบบที่มีโมเลกุลไม่ซับซ้อนมากและง่ายต่อการพิสูจน์หรือแยกสาร ตัวอย่างเช่น อินสุลิน เป็นเปปไทด์ฮอร์โมนที่มีโครงสร้างโมเลกุลไม่ซับซ้อน เปรียบเทียบและลอกแบบได้โดยตรง แต่ยาชีววัตถุคล้ายคลึงบางกลุ่ม เช่น interferon, epoetin, monoclonal antibody เป็นต้น เป็นโปรตีนที่มีกลุ่มน้ำตาลเกาะอยู่ในโมเลกุล (glycosylated protein) หรือมี isoform ที่ต่างกัน โมเลกุลลักษณะนี้จึงมีความซับซ้อนมากกว่าและยากที่จะพิสูจน์คุณลักษณะ ดังนั้นความแตกต่างในกระบวนการผลิตของโมเลกุลประเภทนี้อาจส่งผลต่อคุณสมบัติด้านโครงสร้าง ความแตกต่างทางเภสัชพลศาสตร์และเภสัชจลนศาสตร์ ทำให้เกิดความแตกต่างในด้านความปลอดภัยและประสิทธิภาพ และการเกิดอาการไม่พึงประสงค์จากการใช้ยา คุณภาพและมาตรฐานของหลักฐานที่ใช้สนับสนุนการขึ้นทะเบียนผลิตภัณฑ์ชีววัตถุคล้ายคลึงจึงเป็นสิ่งจำเป็นซึ่งต้องมีเพียงพอเพื่อแสดงว่าผลิตภัณฑ์นี้ผ่านเกณฑ์ที่ยอมรับได้ในด้านคุณภาพ ความปลอดภัย และประสิทธิผล เพื่อประโยชน์ทางการสาธารณสุข นอกจากนี้ ยังเป็นที่คาดหวังว่าความละเอียดครบถ้วนของข้อมูลที่ต้องการและการพิจารณาเพื่อขึ้นทะเบียนผลิตภัณฑ์เหล่านี้จะช่วยผลักดันให้เกิดการพัฒนาผลิตภัณฑ์ชีววัตถุที่มีคุณภาพ ความปลอดภัย และประสิทธิผล ปัจจุบันการรักษาโรคด้วยยาชีววัตถุมีแนวโน้มเพิ่มมากขึ้น องค์กรควบคุมยาทั่วโลกได้ออกแนวทางในการอนุญาตการขึ้นทะเบียนยาชีววัตถุคล้ายคลึง ปัจจุบันจึงมีหลายประเทศที่ได้ออกข้อกำหนด (เช่น สหภาพยุโรป ออสเตรเลีย สิงคโปร์ มาเลเซีย ซาอุดีอาระเบีย ไต้หวัน เกาหลี ญี่ปุ่น เป็นต้น) หรือข้อแนะนำจากองค์การอนามัยโลก (WHO) ในการประเมินและอนุญาตยาชีววัตถุที่เป็นยาชีววัตถุคล้ายคลึง สำหรับประเทศไทย สำนักงานคณะกรรมการอาหารและยาในฐานะหน่วยงานที่รับผิดชอบการอนุญาตทะเบียนตำรับยาได้เล็งเห็นถึงความปลอดภัยของผู้บริโภคในการได้รับยา จึงได้ดำเนินการร่างแนวทางการกำกับดูแลยาชีววัตถุคล้ายคลึงในประเทศไทยและจัดทำหลักเกณฑ์การขึ้นทะเบียนตำรับยาชีววัตถุคล้ายคลึงในประเทศไทย เพื่อให้ได้ยาที่มีคุณภาพ ประสิทธิภาพและมีความปลอดภัยสำหรับประชาชนไทย เหตุที่จำเป็นต้องมีการควบคุม ยาชีววัตถุคล้ายคลึงอย่างเข้มงวดเพราะมีรายงานการเกิด immunogenicity ในยาชีววัตถุหลายชนิดทั่วโลกรวมทั้งประเทศไทย
ในการประเมินยาชีววัตถุว่าเป็นยาชีววัตถุคล้ายคลึงนั้นขึ้นอยู่กับความครบถ้วนของข้อมูลทั้งหมด (totality of evidence) ของการศึกษาเปรียบเทียบ (comparability exercises) ที่สามารถแสดงคุณสมบัติความคล้ายคลึง (biosimilarity) กับยาชีววัตถุอ้างอิงในด้านคุณภาพ ความปลอดภัย และประสิทธิภาพ โดยต้องทำการศึกษาเปรียบเทียบในประเด็นต่างๆ (รูปที่ 1) ดังนี้
เนื่องจากผลิตภัณฑ์ยาชีววัตถุคล้ายคลึงที่ผลิตจากแหล่งผลิตต่างกัน (ผลิตภัณฑ์จากต่างบริษัท) จะทำให้เกิดความแตกต่างของการตอบสนองทางภูมิคุ้มกันในผู้ป่วยแต่ละราย การใช้ผลิตภัณฑ์ยาชีววัตถุสลับไปมา (switching) หรือเปลี่ยนใช้ผลิตภัณฑ์จากแหล่งผลิตอื่น (substitution) ยังไม่มีแนวทางทางวิชาการฉบับใดที่แนะนำวิธีปฏิบัติอย่างถูกต้องเพื่อหลีกเลี่ยงการเหนี่ยวนำ immunogenicity อันจะนำไปสู่ การสูญเสียประสิทธิผลของยา (loss of efficacy) และ/หรือการเกิดอาการไม่พึงประสงค์ เช่น การเกิด pure red cell aplasia ในกรณีที่เกิดimmunogenicity จากการใช้ epoetin EMA (European Medicines Agency) ได้เคยระบุไว้ว่าให้อยู่ในดุลยวินิจของแพทย์ผู้สั่งใช้ยาในกลุ่มนี้ เพื่อให้การติดตามความปลอดภัยจากการใช้ยาเป็นไปอย่างมีประสิทธิภาพและสามารถคาดเดาเหตุการณ์ไม่พึงประสงค์ที่อาจเกิดขึ้นได้ 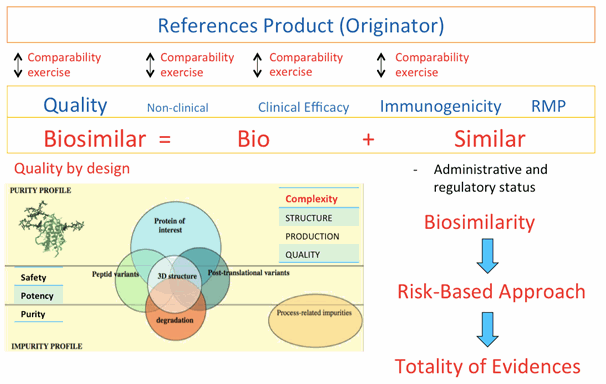
-->